پنجشنبه, ۶ اردیبهشت, ۱۴۰۳ / 25 April, 2024
مجله ویستا
تب هموراژیک کریمه-کنگو

برای اولین بار در سالهای ۱۹۴۴ و۱۹۴۵ میلادی تب هموراژیك كریمه در منطقه كریمه غربی اتحاد جماهیر شوروی سابق توسط یك گرروه كاری به رهبری آقای ام .پ .گوماكف تشخیص داده شد ودر تابستان سالهای ۱۹۴۴ و۱۹۴۵ میلادی نیز بالغ بر ۲۰۰ موردحاد تب هموراژیك كریمه همراه با خونریزی شدید اتفاق افتاد. با توجه به مطالعات تجربی كهدر سال ۱۹۵۶ انجام گرفت ویروس تب كنگو جدا گردید و در سال ۱۹۷۰ مشخص شد كه سویه های ویروسی كه ار آسیای مركزی، بلغارستان و قسمتهای اروپائی اتحاد سابق جماهیر شوروی جدا شده بود از نظر سرولوزیکی كاملأ شبیه هم بودند و از این نظر غیر قابل تفكیك بودند و به همین خاطر آن را تب همراژیك كریمه كنگو نامیدند.
سویه های ویروس از خون افراد مبتلا و كنه های Hyalomma marginatum marginatum جدا گردید بعدها مشخص گردیدكه بیماری مشابهی برای سالهای متمادی دربعضی از نواحی مرزی دریای سیاه و دریای خزر اتحاد جماهیر شوروی سابق وجود داشته است كه دارای همین عوارض بوده است. در سال۱۹۵۶ میلادی در زئیر وكنگو عامل بیماری از خون بچه هائی كه دارای تب بودند جدا گردید ودر همان زمان نیز مشخص گردید كه ویروس در شرق و غرب افریقا وجود دارد. در سال ۱۹۷۰ میلادی دركشور یوگسلاوی سابق آقای Casals نشان دادند كه ویروس عامل این تب از نظر آنتی ژنتیكی و بیولوژیكی به ویروس تب كنگو خیلی شبیه است . در سال ۱۹۷۵ میلادی بر اساس شواهد سرولوژیكی كه در انسان ،گوسفند ،بز و دامهای اهلی كوچك انجام داده بودند فعالیت سرولوژیكی ویروس عامل این تب در ایران تأئید شد.
در همان زمان ویروس عامل این تب در امارات متحده عربی و در سپتامبر همان سال برای اولن بار در بغداد عراق و در منطقه رامدی واقع در ۱۱۰ كیلومتری غرب بغداد تشخیص وشناسائی گردید در عراق اغلب كسانی كه بیمار شده بودند سابقه آنها نشان می داد كه قبلأ با گاو وگوسفند تماس داشته اند در این اپیدمی یك نفر پزشك و یك نفر پرستار نیز در اثر تماس مستقیم با بیماران در بیمارستانی نیز مبتلا گردیده بودند.
ویروس عامل بیماری از خون بیماران و همچنین از نمونه های كبدی جدا گردیده بود و عامل این بیماری از نظر سرولوژیكی به اعضای گروه ویروس تب هموراژیك كریمه-كنگو هر چند كاملأ شبیه نبود ولی خیلی به آن نزدیك بود. در سال ۱۹۹۸ میلادی این بیماری دركشورهای پاكستان و افغانستان گزارش و تا ئید گردید كه در پاكستان باعث مرگ دو نفر ودر افغانستان باعث مرگ ۱۹ نفر شد. در ایران در سالهای ۱۳۷۸ و سال ۱۳۷۹ در استانهای چهار محال بختیاری ،ارومیه،لرستان،سیستان و بلوچستان مواردی گزارش و تأئید شده كه مواردی متأسفانه منجر به مرگ شده است .وزارت بهداشت مواردی را كه دارای علائم بالینی از جمله تب توام با كاهش بیش از حد معمول پلاكتها (Thrombocytopenia ) باشند را اعلام كرده است كه بعنوان موارد مشكوك گزارش نمایند .
● مقدمه:
ویروس تب هموراژیك كریمه-كنگو (CCHF) از خانواده Bunyaviridae و جنس Nairovirus می باشد اندازه آن ۹۰۱۰۰ نانومتر می باشد كه بطور اندمیك توسط كنه های ایكسودیده و آرگاسیده می تواند به انسان منتقل و باعث بیماری شدید گردد. از نظر توزیع جغرافیائی در قسمتهای جنوبی اتحاد جماهیر شوروی سابق اروپا آسیای اروأسیا خاورمیانه و آفریقا این بیماری یافت می شود بطوریكه در سه منطقه از هفت منطقه حیاتی كره زمین این بیماری وجود دارد. دست كم ۳۱ گونه از ۹ جنس كنه های ایكسودیده و آرگاسیده بعنوان حاملین ویروس (CCHF) شناخته شده اند و بیش از ۲۰ گونه از مهره داران مختلف نیز شناخته شده اند كه بطور طبیعی با ویروس (CCHF)آلوده گردیده اند در انسان بیماری اغلب حاد وبسیار كشنده است .
عواملی كه انتقال ویروس (CCHF) را از دام به انسان تحت تأثیر قرار می دهند تراكم و فراوانی كنه ها و فراوانی مهره دارانی است كه بعنوان میزبان كنه ها و نگهدارنده بالقوه ویروس (CCHF) هستند.انتقال ودوام عامل بیماری فقط زمانی وجود دارد كه كنه های جنس هیالوما وجود دارند و اعتقاد بر این است كه همه گیری ویا بروز اپیدمی در مراحلی كه فصل فراوانی كنه های بالغ باشد صورت می گیرد. میزبانهای مهره دار برای اغلب كنه های ایكسودیده شامل پستانداران كوچك و پرندگان برای مراحل لاروی و یا نمفی و پستانداران بزرگ سم دار اهلی میزبان كنه های بالغ هیالوما می باشند ضمنأ پری ولانس آنتی بادی بر علیه ویروس تب هموراژیك كریمه- كنگودر این حیوانات نشان می دهد كه اغلب آنها آلوده به این ویروس می باشند.
● پاتوژنز بیماری تب خون ریزی دهنده کریمه کنگو
ویروس درداخل بدن كنه تكثیر پیدا می كند بطوریكه از مرحله لاروی تا مرحله بلوغ در داخل بدن كنه بصورت(Trans-stadial transmission) می تواندمنتقل بشود ویروس بصورت(Trans-ovarial transmission)نیز منتقل می شود بنابراین كنه نه تنها بعنوان میزبان ویروس می باشد بلكه با توجه باینكه ویروس در سیكل زندگی كنه بصورت عمودی( vertical ) نیز منتقل می شودكنه بعنوان reservoir ویروس نیزعمل می كند در مهره دارانی كه بطور تجربی به ویروسآلوده شده اند سطوح ویرمی و مدت زمان ویرمی نسبتأ كوتاه و كم است و بعد از قطع ویرمی آنتی بادی ها بمقدار كمی قابل تشخیص می باشند.
ویروس از طریق سیستم رتیکولواندوتلیوم گردش می کند این سیستم در برگِرنده طحال کبد مغز استخوان غدد لنفاوی و سایر فضاهای سروزی می باشد در آزمایشات تجربی بعمل آمده یک هفته بعد از کشتار ویروس بیماری از کبد جدا شده است ولی بدلیل اینکه آزمایشگاه درجه چهار برای این ویروس از دیدگاه بیوسیفتی نیاز است بتابر این ردیابی ویروس در تحقیقات تجربی در سیستم رتیکولواندوتلیم عملا انجام نمی پذیرد .
از دیدگاه ویروس شناسی دمای زیر صفر مناسب برای نگهداری ویروس می باشد و می تواند چندین سال باقی بماند .پری ولانس آنتی بادی در گونه های مختلف دامهای بالغ در مناطق اندمیك می تواند بیشتر از ۵۰ درصد باشد .استراتژی های كنترل در انسان شامل پرهیز کشتار دام در مناطقی است که کانون بیماری گزارش شده و کشتارگاهها بایستی تعطیل گردند پرهیز از گزش كنه هاپرهیز از تماس با ترشحات انسان و یا دام که ممکن است آلوده با خون باشند
● مقایسه آنتی ژنی سویه های ویروس
CCHF دارای یك توزیع جغرافیائی بسیار وسیع می باشد ولی از نظر اكولوژیكی توزیع آن متغیر می باشد.علی ایحال انجام مطالعات برای بررسی تفاوتهای آنتی ژنی بین سویه های این ویروس بدلایل فنی محدود شده است .تستهای Cf و AGDP روشهای قابل انجام برای بررسی مطالعات می باشند .
روش Plaque Reduction یك روش سرولوژیكی برای تستهای HI Kenetic می باشد ویروس CCHF بطور جزئی البته نه در تمامی خطوط سلولی بدن ایجاد CPE قابل رویت بصورت جزئی تكثیر پیدا می كند البته ایجاد پلاك در بعضی از سویه ها در خطوط سلولی LL C-MK۲,CV-۱ میمون و محیطهای كشت اولیه میمون سبز افریقای گزارش شده است چنین پلاكهائی معمولأ خیلی كوچك و با تأخیر ظاهر می شوند و برای انجام نیاز به مهارتهای فنی بسیار بالا دارند.با استفاده از تستهای HI و CFوAGDP ارتباط سرولوژیكی بین ویروس CCHF و Nairobi Sheep disease نشان داده است.
آنتی ژنهای HA با اغلب سویه ها براحتی قابل تهیه نمی باشند و نیاز به شرایط خاص در انجام تست می باشند بهترین تیترها حالت ۱:۵۰ و۱:۱۰۰ می باشند .تكثیر ویروس در روی خط سلول های كلیه هامستر خیلی عالی می باشد ولی بدون تشكیل CPE و بدون ایجاد پلاك می باشد.استفاده از نقاط آلودگی تشخیص داده شده با IF و خنثی سازی آنها با استفاده از سرمهای ایمنی ممكن است منجر به مقایسه سرولوژیكی كمی بشود و ممكن است با استفاده از تیتراسیون سرمها با استفاده از IF غیر مستقیم تا حال حاضر نتایج قابل دسترسی بدست نیامده است .● یافته های بالینی:
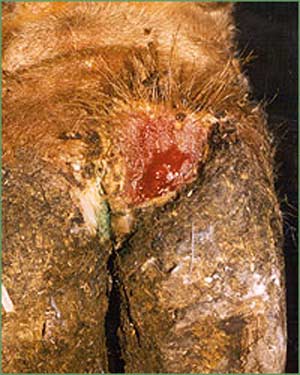
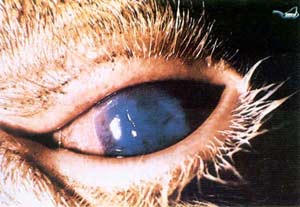
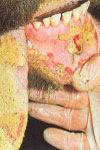
در انسان دوره كمون بستگی به روش آلودگی دارد بطوریكه حد اقل ۳ روز و حداكثر ۹ روز طول می كشد و معمولأ با علائم آنفلوآنزا، سردرد شدید، درد در ناحیه پشت، anorexia و استفراغ تظاهر می كند. بیماران معمولأ از درد در مفاصل و درد عضلانی رنج می برند اسهال از علائم بالینی بیماری می باشد در بعضی از موارد سرفه ، فارانژیت و درد پرده جنب وجود دارد در روزهای دوم و چهارم بیماری نیز بعضی از بیماران علائم خونریزی از خود نشان میدهند.
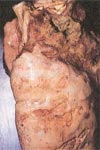
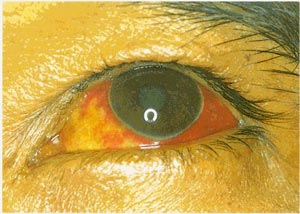
معمولأ در اطراف محل خونگیری و محلهای تزریق هماتوما اتفاق می افتد ودر خیلی از موارد خارج شدن مقدار زیادی خون از رگها در دست و پا باعث گسترش نواحی خون مردگی (echymotic ) می شود. خون ریزی از لثه ها، بینی و در دستگاه ادرای-تناسلی بطور معمول دیده می شود. در مواردی كه منجر به مرگ می شود خون ریزی در دستگاه جهازهاضمه اتفاق می افتد. بیماری در زنان باردار باعث سقط می شود از سایر علائم این بیماری زردی، نارسائی كلیوی، درگیری سیستم عصبی مركزی و در فرم سخت شدن گردن عدم هوشیاری وافزایش حساسیت می باشد در مراحلی كه منجر به مرگ می شود شوك غیر قابل برگشت ونارسائی كبدی-كلیوی می دهد.
در انسان درصد مرگ ومیر(mortalityrate )حاصل از این تب حدود ۳۰ درصد می باشد .در گوسفند و گاو این بیماری بمدت یك هفته ایجاد تب می كند ودر این مدت حالت ویرمی وجود دارد، این تب گذرا بوده و ایجاد مرگ ومیر در دام نمی كند غیر از تب علائم بالینی خاص دیگری نزد دام وجود ندارد ، در مدت زمانی كه در دام ویرمی وجود دارد ویروس عامل بیماری بطور مستقیم و یا بطور غیر مستقیم از طریق كنه های ایكسودیده و آرگاسیده به انسان منتقل و ایجاد بیماری می كند .
● یافته های آزمایشگاهی:
ثابتترین یافته آزمایشگاهی كاهش بیش از حد معمول ترومبوسیتها( Thrombocytopenia )می باشد. سایر یافته های آزمایشگاهی عبارتند از Leukopenia همراه با لنفوسیتهای atypical و در بعضی از موارد لوكوسیتوز در مرحله اولیه بیماری دیده می شود در مراحل اولیه بیماری در كم خونی مختصری دیده می شود .ESR كمی بیش از حد طبیعی است Bleeding time افزایش پیدا می كند زمان پروترومبین افزایش پیدا می كند و مقدار ترومبوپلاستین كمی افزایش پیدا می كند .
مقدار فیبرینوژن كاهش پیدا می كند ولی fibrinogen degration products(FDPS) افزایش پیدا می كند.در مغز استخوان نیز مگاكاریوسیتها كاهش پیدا می كنند.
● یافته های پاتولوژیكی:
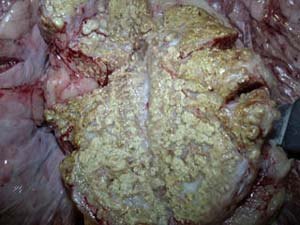
در معاینات بعد از مرگ بزرگ شدن بیش از حد معمول كبد كه بطور ماكروسكوپی قابل تشخیص است رنگ كبد تغییر پیدا می كند وبه رنگ متمایل به زرد دیده می شود.در سطح میكروسكوپی در سلولهای كبدی نكروز وسیع دیده می شود نواحی وسطی و مركزی لبولهای كبدی اغلب درگیر شده اند . اجسام داخل سیتوپلاسمی شبیه Concilman همراه با تراوشات infiltration ) )در نواحی نكروز شده لوبولها به فراوانی دیده می شوند درتوبولها وگلومرولهای كلیه ها نیز معمولأ نكروز انعقادی دیده می شود. در سیستم عصبی مركزی علائم آماس و یا خونریزی دیده نمی شودو شواهدی دال بر حمله ویروس به سیستم عصبی مركزی وجود ندارد
● تشخیص و درمان بیماری
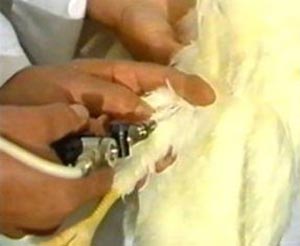
بخاطر نوع بیماری و نحوه انتقال عامل بیماری تشخیص موارد مشكوك بیماری در آزمایشگاههای خیلی مجهز و كاملأ دارای امنیت حیاتی امكان پذیر می باشد. در روز دهم بیماری آنتی بادی های IgG و IgM با استفاده از روش ELISA و یا EIA ممكن است در سرم قابل تشخیص باشند. IgM تا چهار ماه بعد از بیماری و سطح IgG بمرور زمان كاهش پیدا می كند ولی تا پنج سال در سرم قابل تشخیص می باشد .بیمارانی كه بیماری آنها منتج به مرگ می شوند معمولأ یك آنتی بادی قابل اندازه گیری را نشان نمی دهند ، با استفاده از روشهای مختلف در چند روز اول بیماری با استفاده از تشخیص ویروس در خون ویا نمونه های بافتی تشخیص بیماری امكان پذیر می باشد. در پنج روز اول بیماری می توان از خون یا نمونه های بافتی بیمار، ویروس را جدا و در محیط كشت سلولی تكثیر كرد. آنتی ژنهای ویروسی ممكن است با استفاده از روش ایمنوفلورسنت و یا EIA در نمونه های بافتی نشان داده بشوند .
اخیرأ روش PCR كه یك روش مولكولی برای تعیین ژنوم ویروسی می باشد برای تشخیص بیماری استفاده می شود .درمان نگهدارنده كلی برای نگهداری وضعیت حیاتی بیمار در رابطه با بیماری CCHF بكار برده می شود .كنترل حجم خون و جایگزینی اجزاء آن برای نگهداری وضعیت بیماری ضروری است . شكل خوراكی و تزریقی داروی ضد ویروسی RIBAVIRIN در درمان بیماری CCHF با پیشرفت مناسبی همراه بوده است. تا حل حاضر جمع آوری حجم پلاسمای ایمنی از بیماران برای مقاصد درمانی نشان داده نشده است هر چند در چندین حالت مورد استفاده قرار گرفته است .
● پیشگیری و مبارزه
یك واكسن غیر فعال شده كه از طریق مغز موش ساخته شده است در مقیاس خیلی كم در اروپای شرقی استفاده شده است با این وجود واكسنی كه دارای كارائی لازم عین حال بی خطر برای انسان باشد در مقیاس بالا وجود ندارد.كنه های ناقل از نظر تعداد خیلی زیاد و بسیار پراكنده می باشند بنابراین مبارزه با كنه ها بایستی از یك استراتژی منحصر بفرد در چهار چوب فعالیتهای دامپزشكی اجرا گردد.
در مناطقی كه بیماری بصورت اندمیك وجود دارد افرادی كه با دام در تماس می باشند بایستی طوری كار كنند كه از گزش كنه در امان باشند (پوشیدن لباس مناسب شتشوی لباسها با مواد كنه كش ) و از تماس با ترشحات و خون آلوده خودداری نمایند. افرادی كه در بیمارستان و یا كلینیكهای خصوصی با بیماران در تماس می باشند بایستی رعایت مسائل قرنطینه أی بسیار جدی بگیرند.در نمونه گیری خون و سایر بافتهائی كه برای تشخیص جمع آوری می شوند بایستی دقت لازم را جهت جلوگیری از ابتلا بعمل آورند. برای از بین بردن تمامی خطرات احتمالی بایستی نسبت به ضد عفونی محل و از بین بردن ضایعات ولاشه ها اقدام مناسب بعمل آید
● نتیجه گیری وبحث :
كستردگی و پراكندگی ویروس (CCHF) در اروپای جنوبی خاورمیانه افریقا بطور شگفت انگیزی باعث شده است كه این بیماری بعنوان یك بیماری مشترك كه می تواند توسط كنه های ناقل به انسان منتقل بشود مطرح گردد در حال حاضر بر روی فاكتورهای فیزیكی و بیولوژیكی كه باعث پیشگیری محدود شدن و یا افزلیش انتقال ویروس (CCHF) می شود در دنیا كار می شود و مشخص گردیده است كه در فصل فراوانی كنه ها و همچنین در نواحی كه مهره دارانی كه بعنوان میزبان كنه ها و نگهدارنده های بالقوه ویروس (CCHF) می باشند وجوددارد بیماری افزایش پیدا می كند .
بنابر این با توجه به اینكه احتمال همه گیری و یا بروز اپیدمی زمانی متصور است كه جمعیت كنه ها در حد اكثر خود می باشد و سمپاشی اماكن دامی و استفاده از حمام ضد كنه بخصوص در مناطقی از كشور كه شرایط جغرافیائی حساستری را دارند برای از بین بردن وكنترل ناقلین ویروس (CCHF)در راستای حفظ بهداشت عمومی و جلوگیری از بروز همه گیری بیماری دركشوركه خود تبعات سیاسی و اقتصادی فراوانی را بدنبال دارد بسیار حائز اهمیت می باشد.
با توجه به اینكه تب هموراژیك كریمه - كنگو در كشورهای عراق وهمسایگان شمالی كشورمان گزارش و تأیید گردیده است و همچنین با توجه به اینكه در سال ۱۹۷۵ میلادی توسط آقای سیدی تحقیقی سرولوژیكی بر روی سرم انسان و دامهای اهلی كوچك كشورمان انجام گرفته است و حكایت از وجود ویروس (CCHF) دركشورمان می باشد بنابراین پیشنهاد می گردد كه یك تحقیق اپیدمیولوژیكی سرولوژیكی بر روی دامهای كشورمان با استفاده از یك روش نمونه برداری كاملأ آماری (بعنوان مثال نمونه برداری خوشه أی با درجات مختلف )با در نظر گرفتن فاكتورهای مكان جغرافیائی زمان نوع دام وضعیت فیزیولوژیكی دام و …
برای آنالیز فاكتورهای خطرانجام پذیردتا با انتخاب استراتژی و تاكتیك مناسب ازبروز اپیدمی وهمه گیری احتمالی بیماری جلوگیری بعمل آید.در حال حاضر با توجه به اطلاعات حاصله مبنی بر بروز بیماری در بعضی از استانهای مرزی كشور پیشنهاد میگردد در جهت كنترل و به حداقل رساندن خطر پراكندگی ویروس(CCHF) نسبت به سمپاشی منظم اماكن دامی استحمام دامهای منطقه با استفاده از حمامهای ضد كنه وسموم مناسب و اطلاع رسانی درست به دامداران توسط بخش خصوصی و دولتی اقدام گردد.
منبع : اردلان آنلاین
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
ایران سریلانکا توماج صالحی کارگران رهبر انقلاب حجاب پاکستان مجلس شورای اسلامی دولت رئیسی سید ابراهیم رئیسی رئیس جمهور
کنکور سیل سازمان سنجش تهران شهرداری تهران فضای مجازی هواشناسی پلیس سلامت قتل فراجا وزارت بهداشت
قیمت خودرو قیمت طلا خودرو قیمت دلار دلار بازار خودرو بانک مرکزی ایران خودرو قیمت سکه سایپا بورس تورم
تلویزیون سریال ترانه علیدوستی کتاب سینمای ایران فیلم شعر تئاتر سینما
کنکور ۱۴۰۳
اسرائیل آمریکا غزه رژیم صهیونیستی فلسطین روسیه جنگ غزه چین طوفان الاقصی عملیات وعده صادق ترکیه اتحادیه اروپا
فوتبال پرسپولیس لیگ برتر انگلیس استقلال فوتسال بازی تراکتور باشگاه پرسپولیس باشگاه استقلال بارسلونا تیم ملی فوتسال ایران رئال مادرید
هوش مصنوعی همراه اول فیلترینگ ناسا ایلان ماسک اپل تیک تاک تبلیغات فناوری سامسونگ
سلامت روان فرونشست زمین داروخانه پیری سرکه سیب یبوست