جمعه, ۷ اردیبهشت, ۱۴۰۳ / 26 April, 2024
مجله ویستا
کاربردها و چالشهای زیستی نانولولههای کربنی
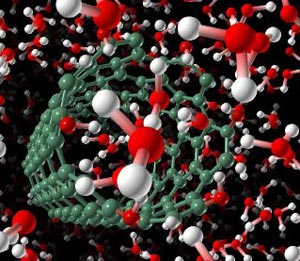
اما پیش از بهکارگیری نانولولههای کربنی در موجودات زنده، باید از سازگاری این ساختارها در بافت زنده مطمئن شد.
به این منظور پژوهشهای زیادی صورت گرفتهاست که تا حدودی سمیت نانولولههای کربنی و عوامل مؤثر بر آن مثل دوز، ساختمان، دنبالههای شیمیایی، سطح فعال و خلوص را مشخص نمودهاست. دانشمندان تاکنون توانستهاند از نانولولههای کربنی در حسگرهای پروتئینی، ناقلهای پروتئینی، میکروسکوپها، داربست بافتی سلول استخوانی و عصبی، کانالهای مولکولی و فرستنده سیگنال به سلولهای عصبی استفاده کنند.
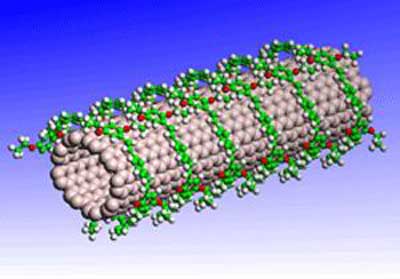
یکی از پرکاربردترین ساختارهای مورد بحث در فناوری نانو که به عرصه علوم زیستی وارد شدهاست، نانولولههای کربنی هستند. این نانوساختارها، بهجهت بهرهمندی از ویژگیهای منحصربهفرد فیزیکی و شیمیایی بالقوه، از تواناییهایی برای استفاده در حسگرهای زیستی، حمل و نقل مولکولی، جستجوی الکتروشیمیایی نمونههای بیولوژیک، داربست بافتی، فرستنده سیگنال به سلولها و روشهای تشخیصی برخوردارند.
اما پیش از بهکارگیری نانولولههای کربنی در موجودات زنده، باید از سازگاری این ساختارها در بافت زنده مطمئن شد. به این منظور پژوهشهای زیادی صورت گرفتهاست که تا حدودی سمیت نانولولههای کربنی و عوامل مؤثر بر آن مثل دوز، ساختمان، دنبالههای شیمیایی، سطح فعال و خلوص را مشخص نمودهاست. دانشمندان تاکنون توانستهاند از نانولولههای کربنی در حسگرهای پروتئینی، ناقلهای پروتئینی، میکروسکوپها، داربست بافتی سلول استخوانی و عصبی، کانالهای مولکولی و فرستنده سیگنال به سلولهای عصبی استفاده کنند.
● معرفی نانولولههای کربنی
▪ تاریخچه
به نظر میرسد اولین رشتههای در مقیاس نانو در سال ۱۹۷۰ میلادی توسط Marinobu Endo از دانشگاه اورلئان فرانسه تهیه شد. این رشتهها هفت نانومتر قطر داشتند و با روش رشد توسط بخار تهیه شده بودند [۱]. با این حال امروزه نام ایجیما از آزمایشگاه NEC در تسوکوبا بهعنوان اولین کسی که توسط HR-TEM در سال ۱۹۹۱ موفق به مشاهده نانولولهها شد، در صدر محققان این رشته باقی ماندهاست [۱و۲و۳و۴]. در همین زمان و به طور مستقل در مسکو نیز دانشمندان موفق به کشف ریزلولههایی شده بودند که البته نسبت طول به قطر آن کمتر از یافتهٔ ایجیما بود.
روسها نام این ماده را Barrelense گذاردند [۱]. آنچه ایجیما موفق به مشاهده آن شده بود نانولوله چند لایه بود و وی به فاصله دو سال موفق به مشاهده نانولوله تکلایه نیز گشت. گروه رایس در ۱۹۹۶ موفق به ساخت دستههای موازی از نانولوله تکلایه شدند که راه را برای تحقیقات بیشتر روی فیزیک کوانتوم تک بعدی باز کرد [۱].
▪ ساختار
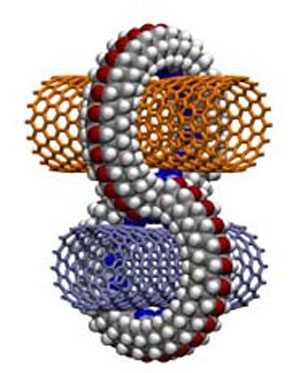
نانولوله بر اساس ساختمان گرافیت بنا میشوند. گرافیت از لایههای مجزایی متشکل از اتمهای کربن تشکیل شدهاست که بهصورت واحدهایی ششضلعی که در شش رأس آن اتم کربن قرار دارد آرایش یافتهاند. قطر نانولوله بین یک تا دو نانومتر و طول آن گاه تا چند میکرومتر نیز میرسد. انتهای هر دو سوی نانولولهها میتواند با نیمهای از یک فولرین مسدود باشد یا نباشد [۱]. و لذا میتواند در انتهای خود علاوه بر اجزای ششضلعی دارای اجزای پنجضلعی نیز باشد[۳]. اما مهمترین ویژگی که در تعیین خصوصیات نانولولهها نقش بازی میکند، با عنوان Chirality یا پیچش شناخته میشود [۱و۲و۴و۵].
از دیگر ویژگیهای ساختاری نانولولهها حضور آنها به دو فرم نانولوله چند لایه با نام اختصاری MWNT و نانولولههای تکلایه با نام اختصاری SWNT است؛ هر یك از این انواع دارای کاربردهای متفاوتی هستند.
▪ روشهای تولید
روشهای تولید نانولولههای کربنی بهاختصار شامل موارد زیر است[۲]:
ـ تبخیر یا سایش لیزری (Laser Vaporization/ablation)؛
ـ رسوبدهی شیمیایی بخار به کمک حرارت (CVD)؛
ـ رسوبدهی شیمیایی بخار به کمک پلاسما (PECVD)؛
ـ رشد فاز بخار؛
ـ الکترولیز؛
ـ سنتز شعله.
▪ خصوصیات فیزیکی و شیمیایی
نانولولهها علیرغم برخورداری از قطر بسیار کم، استحکام کششی بالایی در حدود صد گیگاپاسکال دارند [۲و۵]. از دیگر خصوصیات نانولولهها وجود پیوندهای واندروالس بین اتمها(و لذا توانایی بسیار پایین آنها برای چسبیدن به یکدیگر)، خواص الکتریکی منحصر به فرد (نانولوله فلزی و نیمه هادی) [۱و۲و۳و۵]، رسانایی تنها در جهت طولی [۱و۲]، رسانایی حرارتی و خاصیت نشر میدانی [۲و۶و۷] است. خاصیت نشر میدانی در ساختارهایی که دارای نسبت طول به قطر بالا (بزرگتر از هزار) ، دارای رأس اتمی تیز، ثبات بالای حرارتی و شیمیایی و هدایت بالای الکتریکی و گرمایی باشند، دیده میشود [۷و۸].
● ویژگیهای زیستی نانولولههای کربنی
با وجود خصوصیات متنوع نانولولهها، دور از ذهن نیست که کاربردهای متنوعی نیز داشته باشند. در یک تقسیمبندی ساده میتوان برهمکنشهای زیستی نانولولهها را از دو بعد درونسلولی و برونسلولی مورد بررسی قرار داد.
به طور کلی مهمترین عناوین کاربردهای نانولولهها از دید بیولوژیک عبارتند از:
۱) حسگرهای زیستی؛
۲) حمل و نقل ملکولی؛
۳) جستجوی الکتروشیمیایی نمونههای بیولوژیک؛
۴) داربست بافتی؛
۵) فرستنده سیگنال به سلولها؛
۶) روشهای تشخیصی.
اما یکی از مهمترین مباحث در راه استفاده از کاراییهای نانولوله در بافت زنده، سازگاری زیستی آن است. لذا ابتدا مطالعات صورت گرفته در این زمینه را مرور میكنیم.
▪ سازگاری زیستی
جلب نظر دانشمندان به سازگاری زیستی نانولولهها و اثرات مضر احتمالی آنها بر سلولها، به این واقعیت برمیگردد که در سالهای اخیر با افزایش روز افزون کاربردهای نانولولهها در صنعت و حضور بیشتر آنها در محیط، ارتباط معناداری بین آنها و بیماریهایی از جمله بیماریهای تنفسی [۹] و پوستی [۱۰] پیدا شدهاست.
این امر مراکز علمی و تحقیقاتی را بر آن داشته است تا به بررسی اساسی این تأثیرات، یعنی تأثیر نانولوله بر سلول بپردازند. علیرغم مطالعاتی که در ابتدا نشان میداد که نانولوله و همخانوادههای آن تأثیر چندانی بر مورفولوژی، رشد و تکثیر سلولی ندارند [۱۱]، امروزه مشخص شدهاست که شاخصهایی چون ابعاد فیزیکی، مساحت، دوز، نسبت طول به قطر، زمان، خلوص و وجود عوامل شیمیایی متصل به سطح، هر یک به نوبه خود در خاصیت سیتوتوکسیتی نانولوله مؤثرند [۱۲و۱۳و۱۴و۱۵]. هر یک از مطالعات صورت گرفته روی یکی از متغیرهای مذکور تمرکز بیشتری دارند، اما به نظر میرسد که دوز، خلوص و حضور دنبالههای شیمیایی متصل به سطح از موارد مهمتر باشند.
مطالعات نشان دادهاند که آستانه اثر کشندگی نانولوله برای نانولولههای چند دیواره و تکدیواره ، حدود ۰۶/۳ میکروگرم در میلیلیتر است که این رقم در برابر C۶۰ (فولرین) که تا ۲۲۶ میکروگرم در میلیلیتر نیز اثر کشندگی برای سلول ندارد، رقمی قابل توجه است [۱۶]. آخرین و مهمترین مقاله منتشر شده در این زمینه توسط انجمن شیمی آمریکا، در مقایسهای بین سیتوکسیتی MWCNT، SWCNT، کوارتز و C۶۰، بهترتیب توان کشندگی این مواد برای سلول را به این شکل بیان میکند:
C۶۰ < کوارتز < SWCNT > MWCNT
نکته جالب آن است که اگر چه با افزایش دوز نانولوله در محیط کشت، اثر کشندگی آن نیز افزایش مییابد، اما این ارتباط، خطی و منظم نیست [۱۵]. نکته دیگر در مورد اثر دوز اینکه نانولوله در دوزهای پایین اثری عکس اثرات آن در دوزهای بالا دارد.
بررسیها نشان میدهد که نانولولهٔ خالص دارای اثرات سمی بیشتری نسبت به نوع ناخالص آن است[۱۲]. اما مهمتر از خلوص، اثر عوامل شیمیایی بر روی سطح نانولوله است که موجب کاهش اثرات سمی آن میشود [۱۳]. اضافه نمودن عوامل شیمیایی بر روی سطحِ نانولوله را فعال سازی (Functionalization) میگویند که به نوبه خود موجب تسهیل بهکارگیری نانولوله در صنایع میگردد.
برخی از مطالعات به نحوهٔ اثر نانولوله در سلول و علت مستقیم مرگ سلولی ناشی از آن اختصاص دارند. به طور کلی سلولها در مواجهه با نانولوله، پاسخهای گسترده و بعضاً متناقضی از خود نشان میدهند.این پاسخهای سلولی عبارتند از: فعالسازی ژنهای مؤثر در حمل و نقل سلولی، متابولیسم، تنظیم سیکل سلولی و رشد سلولی پاسخهای استرسی و اکسیداتیو، تولید و ترشح پروتئین از سلول، توقف رشد سلولی و در نهایت آپوپتوز و نکروز [۱۰و۱۴و۱۵و۱۷].
طبق مطالعات صورت گرفته، نانولولهها در دوزهای پایینتر موجب افزایش رشد و متابولیسم سلولی و در دوزهای بالاتر موجب واکنشهای التهابی و پاسخهای ایمنی سلولی، مشابه وضعیتی که در برابر تهاجم یک عفونت وریدی از خود نشان میدهد، میشوند [۱۵]. در واقع مرگ سلولها در مواجهه با نانولولهها مشابه دیگر موارد مرگ سلولی، ناشی از تشکیل رادیکالهای آزاد و عوارض ناشی از آن، تخلیه مواد آنتیاکسیدان و up-regulation برخی از ژنها و down-regulation برخی از ژنهای دیگر است [۱۰و۱۴و۱۷].
اثرات نانولوله بر روی بیان ژنی که تا به حال کشف شدهاست عبارت است از: up-regulation بیان ژنهای مؤثر در سیکل سلولی مثل P۳۸, CdC۳۷, CdC۴۲, hrk, P۵۷, bax, P۱۶ و Down-regulation بیان ژنهای مؤثر در سیکل سلول مثل Cdk۲ و Cdk۴، Cdk۶ و Cyclin D۳ و نیز down-regulation بیان ژنهای مرتبط با سیگنالهای سلولی مثل pcdha۹, ttk, jak۱, mad۲ و erk. همچنین موجب القای down-regulation بیان پروتئینهای دخیل در اتصالات سلولی مانند لامینین، فیبرونکتین، کادهرین و FAR و کلاژن نوع چهار میشوند[۱۴و۱۷].
از این میان دانشمندان مهمترین تأثیر نانولولهها را در سیکل میتوز در مرحله G۱ میدانند و توقف سلول در فاز G۱ را عامل اصلی آپوپتوز قلمداد میکنند[۱۷].
● نانولولههای کربنی: ابزارهای قدرتمند زیستی
چنانچه عنوان شد، با در نظر گرفته خطرات احتمالی نانولولهها برای سلول و بافت، این ساختارهای نانویی بالقوه از کاربردهای فراوانی در موجودات زنده برخوردارند. اگرچه ترس از عدم سازگاری زیستی موجب کند شدن روند تحقیقات در این زمینه شدهاست، با این حال تاکنون دانشمندان به نتایج قابل قبولی نیز دست یافتهاند که در ادامه به آنها اشاره میشود.
▪ حسگرهای زیستی
هرگونه تغییری در ساختمان و اجزای نانولولهها موجب تغییر در قدرت هدایت الکتریکی آنها خواهد شد. دانشمندان دریافتهاند که فعالسازی نیز متناسب با خصوصیات مولکول پیوند شده، موجب تغییراتی در هدایت الکتریکی و تابش نور از نانولوله میشود که منحصر به همان مولکول است[۱۸]. تاکنون مطالعاتی روی پروتئینها، کربوهیدارتها و آنتیبادیهای مختلف صورت گرفتهاست که همگی تأییدی بر این فرضیه بودهاند[۱۸و۱۹و۲۰]. لذا متصور خواهد بود که با حضور هر نوع مولکول در محیط حاوی نانولوله و اتصال به آن میتوان فرکانس الکتریکی یا طول نورانی متفاوتی را ثبت کرد و به حضور آن ماده در محیط پی برد.
▪ حمل و نقل ملکولی
تاکنون مطالعاتی روی توانایی نانولولهها در جابهجا نمودن مولکولها صورت گرفتهاست. این بررسیها غالباً به دو دسته تقسیم میشوند: مطالعاتی که به بررسی عبور مولکولها از درون نانولوله [۲۰] و جاگذاری مولکولها درون آنها [۲۹] اختصاص دارند و مطالعاتی که بر پایه اتصال مولکولها به سطح نانولوله و انتقال از این طریق بنا شدهاند[۲۱]. در نوع اول دانشمندان موفق به مشاهده عبور مولکول آب، +H، برخی از یونها و بعضاً پلیمرها از درون نانولوله شدهاند[۲۰]، آنها با جایگذاری داروهای ضد سرطان (مثل سیس پلاتین) درون نانولولهها موفق به انتقال آنها به اطراف سلول و آزادسازی آهستهٔ آنها از درون نانولوله شدهاند[۲۹].
در نوع دیگر عموماً نقل و انتقال پروتئینها توسط نانولولهها بررسی شدهاست. این مطالعات نشان میدهند که با فعال سازی نانولوله توسط بنیان اسیدی میتوان قابلیت اتصال این مواد به پروتئینها را افزایش داد و به این طریق انتقال پروتئینها به درون سلول را تسهیل کرد[۲۱]. البته این توانایی نانولولهها به اندازه پروتئین نیز بستگی دارد و در اندازههای بزرگتر این توانایی از نانولوله صلب میشود. در همین رابطه میتوان توانایی نانولوله را برای انتقال ژنها به درون سلول نیز ذکر کرد [۲۲]. که البته مطالعات در این زمینه همچنان ادامه دارد. چنانچه بتوان از نانولوله به عنوان ناقل ژنی استفاده کرد، میتوان آینده درخشانی را برای ژندرمانی و روشهای مشابه متصور بود.
▪ داربست بافتی
اخیراً توجه دانشمندان به این قابلیت نانولولهها جلب شدهاست که همانند داربستهای طبیعی بافتی محتوی کلاژن، میتوانند به عنوان داربست (Scaffold) برای رشد سلولهای روی آنها مورد استفاده قرار بگیرند. احتمالاً ایده اولیه از آنجا منشأ میگیرد که نانولولهها هنگام تولید به صورت رشتههایی درهم آرایش مییابند که به آن فرم ماکارونی اطلاق میشود. این مشابه وضعیت کلاژنها در مایع خارج سلولی است.
نام دیگر این آرایش bucky paper است [۱۹]. دانشمندان دریافتهاند که SWCNTهای بافته نشده (non woven) دارای خاصیت داربستی بیشتری نسبت به دیگر انواع هستند. در این حال قابلیت تکثیر و چسبندگی سلولی نیز افزایش چشمگیری دارد [۲۳].
مهمترین دستاورد محققان در این زمینه، کشت استئوبلاستها روی نانولولههاست که بهتازگی در مقالهای توسط محققان دانشگاه کالیفرنیا در سال ۲۰۰۶ منتشر شدهاست و توجهات زیادی را به خود جلب کردهاست. این یافته راه را برای به کارگیری نانولولهها در ترمیم آسیبهای سلولی باز میکند [۲۴].
بیش از این نیز اتصالات محکم استئوبلاستها به داربست نانولولهای توسط filopodiaهای شکلگرفته در حین کشت به اثبات رسیده بود [۲۵]. با این حال مطالعاتی نیز نشان میدهند که اتصالات بین سلول و داربست نانولوله سست بود و سلولها قادر به نفوذ به داربست نیستند[۸].
یافته دیگری که توسط دانشگاه کالیفرنیا اعلام شدهاست، احتمال بهكارگیری نانولولهها در ترمیم ضایعات نخاعی است. در این حال حضور نانولولهها در محیط موجب هدایت رشد آکسونی میشود[۲۶].
▪ دیگر کاربردها
دیگر کاربردهایی که امروزه مطالعاتی بر روی آنها در حال انجام است عبارتند از: الف) فرستادن سیگنال به سلولهای عصبی [۲۷] که در آن همزمان با ایجاد داربست مناسب برای رشد سلولهای عصبی (توسط فعالسازی مناسب نانولولهها) میتوان سیگنالهای الکتریکی را به سلول عصبی فرستاد؛ ب) روشهای تشخیصی زیستی [۲۸] که اولین مرحله این کاربرد بر روی مالاریا و تشخیص گلبولهای قرمز آلوده به این تک یاخته Plasmodium falciparum صورت گرفتهاست و در حقیقت میکروسکوپ AFM بر این پایه عمل میکند؛ ج) جستجوی الکتروشیمیایی [۲۰] که در واقع از خاصیت قطبیتپذیری نانولولهها استفاده و آن را به ابزاری تحت عنوان «ion-nanotube terahertz osillator» تبدیل کردهاست. در این حالت یون مورد نظر (مثلاً +K) با گیرافتادن در دالان نانولوله با فرکانس بالا شروع به حرکت به دو سوی نانولوله میکند. حاصل این فرایند ایجاد جریان الکتریکی متناوب با فرکانس بالا خواهد بود که از خارج قابل اندازهگیری است.
● جمع بندی
نانولولههای کربنی به جهت قدرت الاستیسیتهٔ بالا و در عین حال استحکام فوق العاده، به عنوان داربست سلولی برای رشد سلولهای استخوانی و عصبی مورد استفاده قرار گرفتهاند. به علاوه در عین حال که سلولها روی شبکهای تور مانند از این مواد شروع به رشد و تکثیر میکنند، دانشمندان توانستهاند از قابلیت هدایت ویژه الکتریکی نانولولههای کربنی استفاده و از آنها به عنوان راهی برای فرستادن پیام به سلولها استفاده کنند.
این یافتهها تداعیکنندهٔ نیاز مبرم علم پزشکی و مخصوصاً شاخههای جراحی پلاستیک و پیوند اعضا، به رشد و تکثیر و پرورش سلولهای مورد نظر در خارج از بدن و سپس انتقال آنها به بدن است.
در این فرایند کاستن از رد شدن بافت پیوندی توسط دستگاه ایمنی بدن از جایگاه ویژهای برخوردار است که تحقیقات چند سال اخیر روی سازگاری زیستی نانولولههای کربنی آن را نشان دادهاست. با تغییراتی در ساختار و ترکیبات این مواد میتوان آنها را به ساختمانهایی سازگار با دستگاه ایمنی بدن تبدیل کرد. بهعلاوه اتصال محکم سلولها به این ساختارها مشکل دیگر پیوند اعضا، یعنی سستی سلولها پس از پیوند را مرتفع خواهد ساخت.
همچنین قابلیت ذخیرهسازی مولکولها در داخل نانولولههای کربنی، درهای تازهای را به روی حمل و نقل مواد حاجب و داروها در داخل بدن گشودهاست؛ چنانچه هر دوی این کاربردها در خارج از بدن انسان به اثبات رسیدهاند. مشابه این کاربرد، توانایی نانولولههای کربنی فعالسازی شده برای اتصال به پروتئینها و انتقال آنها به داخل سلول است که به تازگی نظر دانشمندان را به خود جلب نمودهاست.
از مهمترین و اولین کاربردهای نانولولههای کربنی در محیطهای زنده، توانایی آنها برای اتصال به مولکولهای آلی مختلف و امکان جستجوی آن ماده بر اساس تغییرات هدایت الکتریکی نانولوله بودهاست. این کاربرد، از برجستهترین تقابلهای علم الکترونیک و بیولوژی در بهرهبرداری از فناورینانو بودهاست.
با توجه به آنچه گذشت و طبق اطلاعات موجود از امکانات حال حاضر کشورمان، به نظر میرسد که با برقراری ارتباط بیشتر بین محققان علوم زیستی و علوم مهندسی، هیچیک از این کاربردها هم اکنون دست نایافتنی نیستند.
در حقیقت ذکر چنین کابردهایی از نانولولههای کربنی که تنها یک نانوذره از میان هزاران نانوذرهٔ موجود است، هدفی به جز ایجاد انگیزه بیشتر برای ورود مهندسان علوم الکترونیک، مواد و شیمی به حوزه علوم زیستی و بالعکس آشنایی بیشتر محققان علوم زیستی با بعد فنی و مهندسی فناوری نانو نخواهد داشت.
منابع
۱. Mildred D. , Gene D. , Peter E. , Richiro S., Carbon nanotubes. Physics World ۱۹۹۸; Issue ۱
۲. Nanotechnology Opportunity Report II
۳. Sigma Aldrich. Fullerenes and Carbon Nanotubes - Structure, Properties and Potential Applications.
۴. Thomas A. A. Physical properties of carbon nanotubes. Science, Engineering and Technology ۲۰۰۰
۵. Hongjie D. , Tom G. . AN INTRODUCTION TO CARBON NANOTUBES. Polymer Interfaces and Macromolecular Assemblies ۲۰۰۳
۶. Philip G. Collins and A. Zettl, Unique characteristics of cold cathode carbon-nanotube-matrix field emitters. Phys. Rev. ۱۹۹۷; ۹۳۹۱ – ۹۳۹۹
۷. Saito R. , Dresselhaus G. , Dresselhaus M. S. IEEE Electrical Insulation Magazine ۱۹۹۸; pp ۲۷۲
۸. Julian H. G. , Milo M. S. , Molly M. S. Nanofibrous Materials for Tissue Engineering. Journal of Experimental Nanoscience ۲۰۰۶; ۱ (۱) p ۱
۹. Saugandhika M. , Nathalia P. Low Impedance electrodes for Biological applications using carbon nanotubes. George Mason University
۱۰. Shvedova A. A. , Castranova V. , Kisin E. R. , Schwegler-berry D. , Murray A. R. , Gandelsman V. Z. , Maynard A. , Baron P. Exposure to carbon nanotube material: Assessment of nanotube cytotoxicity using human keratinocyte cells. Journal of toxicology and environmental health ۲۰۰۳; ۲۰ (۶۶) : ۱۹۰۹-۱۹۲۶
۱۱. Ajima K, Yudasaka M, Murakami T, Maigne A, Shiba K, Iijima S. Carbon nanohorns as anticancer drug carriers. Mol Pharm. ۲۰۰۵; ۲ (۶) : ۴۷۵-۸۰.
۱۲. Furong T. , Daxiang C. , Heinz S. , Giovani G. E. , Hisatashi K. Cytotoxicity of single-wall carbon nanotubes on human fibroblasts. Toxicology in Vitro ۲۰۰۶; ۲۰: ۱۲۰۲-۱۲۱۲
۱۳. Christie M. S. , Feng L. , Jared L. H. , Joe M. , Wenhua G. , Jonathan M. B. , Valerie C. M. , Condell D. D. , Jennifer L. W. , Edward B. , Kevin D. A. , Vicki L. C. Functionalization density dependence of single-walled carbon nanotubes cytotoxicity in vitro. Toxicol Lett ۲۰۰۶; ۱۶۱ (۲) : ۱۳۵۱۴۲. ۲۴۸
۱۴. Ding L. , Stilwell J. , Zhang T. , Elboudwarej O. , Jiang H. , Selegue J. P. , Cooke P. A. , Gray J. W. , Chen F. F. Molecular characterization of the cytotoxic mechanism of multiwall carbon nanotubes and nano-onions on human skin fibroblast. Nano Letters ۲۰۰۵; ۵ (۱۲) : ۲۴۴۸- ۲۴۶۴
۱۵. Murr L. E. , Garza K. M. , Soto K. F. , Carrasco A. , Powell T. G. , Ramirez D. A. , Guerrero P. A. , Lopez D. A. , Venzor J. Cytotoxicity Assessment of Some Carbon Nanotubes and Related Carbon Nanoparticle Aggregates and the Implications for Anthropogenic Carbon Nanotube Aggregates in the Environment. Int. J. Environ. Res. Public Health ۲۰۰۵, ۲ (۱) : ۳۱–۴۲
۱۶. Guang J. , Haifang W. , Lei Y. , Xiang W. , Rongjuan P. , Tao Y. , Yuliang Z. , Xinbiao G. Cytotoxicity of Carbon Nanomaterials: Single-Wall Nanotube, Multi-Wall Nanotube, and Fullerene. Environ. Sci. Technol ۲۰۰۵; ۳۹ (۵) : ۱۳۷۸ -۱۳۸۳
۱۷. Cui D. , Tian F. , Ozkan C. S. , Wang J. , Gao H. Effect of single wall carbon nanotubes on human HEK۲۹۳ cells. Toxicology Letters ۲۰۰۵; ۱۵۵: ۷۳-۸۵
۱۸. Ranjani S. , Kasif T. , Balaji P. Biological Functionalization of Carbon Nanotubes. International Conference on MEMS, NANO and Smart Systems (ICMENS&#۰۳۹;۰۴) ۲۰۰۴; pp. ۴۸-۵۳
۱۹. Sotiropoulou, S. , Chaniotakis, N. A. Nanotube Biosensors. Anals of Bioanalytical Chemistry ۲۰۰۳, ۳۷۵ ۲۰۰۳, ۱۰۳
۲۰. Deyu Lu, Yan Li, Umberto Ravaioli, and Klaus Schulten. Empirical nanotube model for biological applications. Journal of Physical Chemistry۲۰۰۵; B, ۱۰۹: ۱۱۴۶۱-۱۱۴۶۷
۲۱. Nadine W. S. K. , Hongjie D. Carbon nanotubes as intracellular protein transporters: generality and biological functionality J. Am. Chem. Soc. ۲۰۰۵; ۱۲۷ (۱۶) : ۶۰۲۱ -۶۰۲۶
۲۲. Pu-Chun K. , Qi L. , Jessica M. , Rahul R. , Katherine F. , Apparao R. Single-Walled Carbon Nanotube Transporter for Gene Delivery. American Physical Society, APS March Meeting, March ۲۱-۲۵, ۲۰۰۵
۲۳. Jie M. , Li S. , Jie M. , Hua K. , Guangjin Z. , Chaoying W. , Lianghua X. , Sishen X. , Haiyan X. Using single-walled carbon nanotubes nonwoven films as scaffolds to enhance long-term cell proliferation in vitro. Journal of Biomedical Materials Research ۲۰۰۵; ۲ (۷۹) : ۲۹۸ - ۳۰۶
۲۴. Zanello L. , Zhao B. , Hu H. , Haddon C. R. Bone Cell Proliferation on Carbon Nanotubes. Nano Letters ۲۰۰۶
۲۵. Aoki N. Yokoyama A. Nodasaka Y. Akasaka T. Uo M. Sato Y. Tohji K. Watari F. Cell Culture on a Carbon Nanotube Scaffold. Journal of Biomedical Nanotechnology ۲۰۰۵; ۴ (۱) : ۴۰۲-۴۰۵
۲۶. Zhang X. , Prasad S. , Niyogi S. , Ozkan M. , Ozkan C. S. Guided Neurite Growth on Patterned Carbon Nanotubes. Nanotech ۲۰۰۵; ۳۰۴ - ۳۰۷
۲۷. Ying Z. , Qunfen Z. , Yuguo L. , Xiaoqing C. , Wenxin L. The Interaction and Toxicity of Multi-Walled Carbon Nanotubes with Stylonychia Mytilus. J. Nanosci. Nanotechnol ۲۰۰۶; ۶: ۱۳۵۷–۱۳۶۴
۲۸. Eriko N. , Hirohide N. , Seiji A. , Yoshikazu N. , James A. D. The cell biological application of carbon nanotube probes for atomic force microscopy: comparative studies of malaria-infected erythrocytes. Journal of Electron Microscopy۲۰۰۰; ۴۹ (۳) : ۴۵۳-۴۵۸
۲۹. Kumiko A. , Masako Y. , Tatsuya M. , Alan M. , Kiyotaka S. , and Sumio I. Carbon Nanohorns as Anticancer Drug Carriers. Mol. Pharmaceutics ۲۰۰۵, ۲ (۶) : ۴۷۵ -۴۸
۱. Mildred D. , Gene D. , Peter E. , Richiro S., Carbon nanotubes. Physics World ۱۹۹۸; Issue ۱
۲. Nanotechnology Opportunity Report II
۳. Sigma Aldrich. Fullerenes and Carbon Nanotubes - Structure, Properties and Potential Applications.
۴. Thomas A. A. Physical properties of carbon nanotubes. Science, Engineering and Technology ۲۰۰۰
۵. Hongjie D. , Tom G. . AN INTRODUCTION TO CARBON NANOTUBES. Polymer Interfaces and Macromolecular Assemblies ۲۰۰۳
۶. Philip G. Collins and A. Zettl, Unique characteristics of cold cathode carbon-nanotube-matrix field emitters. Phys. Rev. ۱۹۹۷; ۹۳۹۱ – ۹۳۹۹
۷. Saito R. , Dresselhaus G. , Dresselhaus M. S. IEEE Electrical Insulation Magazine ۱۹۹۸; pp ۲۷۲
۸. Julian H. G. , Milo M. S. , Molly M. S. Nanofibrous Materials for Tissue Engineering. Journal of Experimental Nanoscience ۲۰۰۶; ۱ (۱) p ۱
۹. Saugandhika M. , Nathalia P. Low Impedance electrodes for Biological applications using carbon nanotubes. George Mason University
۱۰. Shvedova A. A. , Castranova V. , Kisin E. R. , Schwegler-berry D. , Murray A. R. , Gandelsman V. Z. , Maynard A. , Baron P. Exposure to carbon nanotube material: Assessment of nanotube cytotoxicity using human keratinocyte cells. Journal of toxicology and environmental health ۲۰۰۳; ۲۰ (۶۶) : ۱۹۰۹-۱۹۲۶
۱۱. Ajima K, Yudasaka M, Murakami T, Maigne A, Shiba K, Iijima S. Carbon nanohorns as anticancer drug carriers. Mol Pharm. ۲۰۰۵; ۲ (۶) : ۴۷۵-۸۰.
۱۲. Furong T. , Daxiang C. , Heinz S. , Giovani G. E. , Hisatashi K. Cytotoxicity of single-wall carbon nanotubes on human fibroblasts. Toxicology in Vitro ۲۰۰۶; ۲۰: ۱۲۰۲-۱۲۱۲
۱۳. Christie M. S. , Feng L. , Jared L. H. , Joe M. , Wenhua G. , Jonathan M. B. , Valerie C. M. , Condell D. D. , Jennifer L. W. , Edward B. , Kevin D. A. , Vicki L. C. Functionalization density dependence of single-walled carbon nanotubes cytotoxicity in vitro. Toxicol Lett ۲۰۰۶; ۱۶۱ (۲) : ۱۳۵۱۴۲. ۲۴۸
۱۴. Ding L. , Stilwell J. , Zhang T. , Elboudwarej O. , Jiang H. , Selegue J. P. , Cooke P. A. , Gray J. W. , Chen F. F. Molecular characterization of the cytotoxic mechanism of multiwall carbon nanotubes and nano-onions on human skin fibroblast. Nano Letters ۲۰۰۵; ۵ (۱۲) : ۲۴۴۸- ۲۴۶۴
۱۵. Murr L. E. , Garza K. M. , Soto K. F. , Carrasco A. , Powell T. G. , Ramirez D. A. , Guerrero P. A. , Lopez D. A. , Venzor J. Cytotoxicity Assessment of Some Carbon Nanotubes and Related Carbon Nanoparticle Aggregates and the Implications for Anthropogenic Carbon Nanotube Aggregates in the Environment. Int. J. Environ. Res. Public Health ۲۰۰۵, ۲ (۱) : ۳۱–۴۲
۱۶. Guang J. , Haifang W. , Lei Y. , Xiang W. , Rongjuan P. , Tao Y. , Yuliang Z. , Xinbiao G. Cytotoxicity of Carbon Nanomaterials: Single-Wall Nanotube, Multi-Wall Nanotube, and Fullerene. Environ. Sci. Technol ۲۰۰۵; ۳۹ (۵) : ۱۳۷۸ -۱۳۸۳
۱۷. Cui D. , Tian F. , Ozkan C. S. , Wang J. , Gao H. Effect of single wall carbon nanotubes on human HEK۲۹۳ cells. Toxicology Letters ۲۰۰۵; ۱۵۵: ۷۳-۸۵
۱۸. Ranjani S. , Kasif T. , Balaji P. Biological Functionalization of Carbon Nanotubes. International Conference on MEMS, NANO and Smart Systems (ICMENS&#۰۳۹;۰۴) ۲۰۰۴; pp. ۴۸-۵۳
۱۹. Sotiropoulou, S. , Chaniotakis, N. A. Nanotube Biosensors. Anals of Bioanalytical Chemistry ۲۰۰۳, ۳۷۵ ۲۰۰۳, ۱۰۳
۲۰. Deyu Lu, Yan Li, Umberto Ravaioli, and Klaus Schulten. Empirical nanotube model for biological applications. Journal of Physical Chemistry۲۰۰۵; B, ۱۰۹: ۱۱۴۶۱-۱۱۴۶۷
۲۱. Nadine W. S. K. , Hongjie D. Carbon nanotubes as intracellular protein transporters: generality and biological functionality J. Am. Chem. Soc. ۲۰۰۵; ۱۲۷ (۱۶) : ۶۰۲۱ -۶۰۲۶
۲۲. Pu-Chun K. , Qi L. , Jessica M. , Rahul R. , Katherine F. , Apparao R. Single-Walled Carbon Nanotube Transporter for Gene Delivery. American Physical Society, APS March Meeting, March ۲۱-۲۵, ۲۰۰۵
۲۳. Jie M. , Li S. , Jie M. , Hua K. , Guangjin Z. , Chaoying W. , Lianghua X. , Sishen X. , Haiyan X. Using single-walled carbon nanotubes nonwoven films as scaffolds to enhance long-term cell proliferation in vitro. Journal of Biomedical Materials Research ۲۰۰۵; ۲ (۷۹) : ۲۹۸ - ۳۰۶
۲۴. Zanello L. , Zhao B. , Hu H. , Haddon C. R. Bone Cell Proliferation on Carbon Nanotubes. Nano Letters ۲۰۰۶
۲۵. Aoki N. Yokoyama A. Nodasaka Y. Akasaka T. Uo M. Sato Y. Tohji K. Watari F. Cell Culture on a Carbon Nanotube Scaffold. Journal of Biomedical Nanotechnology ۲۰۰۵; ۴ (۱) : ۴۰۲-۴۰۵
۲۶. Zhang X. , Prasad S. , Niyogi S. , Ozkan M. , Ozkan C. S. Guided Neurite Growth on Patterned Carbon Nanotubes. Nanotech ۲۰۰۵; ۳۰۴ - ۳۰۷
۲۷. Ying Z. , Qunfen Z. , Yuguo L. , Xiaoqing C. , Wenxin L. The Interaction and Toxicity of Multi-Walled Carbon Nanotubes with Stylonychia Mytilus. J. Nanosci. Nanotechnol ۲۰۰۶; ۶: ۱۳۵۷–۱۳۶۴
۲۸. Eriko N. , Hirohide N. , Seiji A. , Yoshikazu N. , James A. D. The cell biological application of carbon nanotube probes for atomic force microscopy: comparative studies of malaria-infected erythrocytes. Journal of Electron Microscopy۲۰۰۰; ۴۹ (۳) : ۴۵۳-۴۵۸
۲۹. Kumiko A. , Masako Y. , Tatsuya M. , Alan M. , Kiyotaka S. , and Sumio I. Carbon Nanohorns as Anticancer Drug Carriers. Mol. Pharmaceutics ۲۰۰۵, ۲ (۶) : ۴۷۵ -۴۸
منبع : ستاد ویژه توسعه فناوری نانو
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
طالبان دولت رئیس جمهور توماج صالحی رئیسی گشت ارشاد رهبر انقلاب کارگران سریلانکا پاکستان مجلس شورای اسلامی دولت سیزدهم
کنکور تهران حجاب سیل هواشناسی سازمان سنجش شهرداری تهران پلیس اصفهان سلامت فراجا وزارت بهداشت
قیمت خودرو قیمت طلا خودرو قیمت دلار دلار بازار خودرو مسکن بانک مرکزی ایران خودرو ارز قیمت سکه سایپا
ترانه علیدوستی تلویزیون گردشگری سریال سینمای ایران مهران مدیری کتاب تئاتر موسیقی
کنکور ۱۴۰۳ عبدالرسول پورعباس
غزه اسرائیل روسیه رژیم صهیونیستی فلسطین جنگ غزه حماس چین طوفان الاقصی اوکراین ترکیه عربستان
فوتبال پرسپولیس استقلال بارسلونا بازی ژاوی باشگاه پرسپولیس باشگاه استقلال فوتسال تراکتور لیگ برتر انگلیس والیبال
تیک تاک همراه اول ناسا اپل فیلترینگ وزیر ارتباطات مایکروسافت عیسی زارع پور
مالاریا کاهش وزن پیری سلامت روان داروخانه