پنجشنبه, ۶ اردیبهشت, ۱۴۰۳ / 25 April, 2024
مجله ویستا
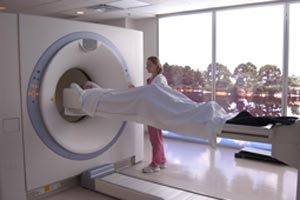
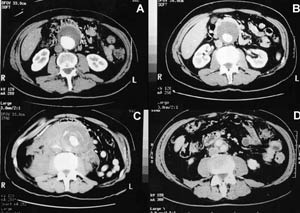
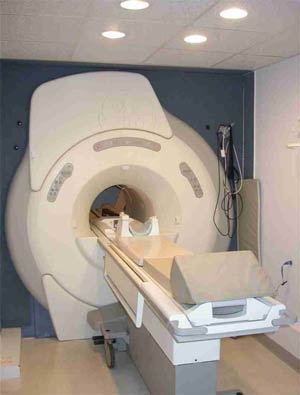
پدیده ای تازه در دستگاه های جدید MRI
با توجه به این که اتم های هیدروژن در آب و چربی بافت های مختلف بدن به وفور یافت می شوند و سیگنال های قویتری از آن به دست میآید و همچنین گشتاور مغناطیسی آنها با میدان مغناطیسی خارجی سریع تر انطباق می یابد، جهت تصویربرداری به شیوهMRI مورد استفاده قرار گرفته اند. در شرایطی که اتم های بدن بیمار درون یک میدان مغناطیسی قوی قرار گیرد، تحت تاثیر میدان قرار گرفته و بردار برایند مغناطیسی آنها در راستای این میدان مغناطیسی قرار می گیرد. در این شرایط اکثر گشتاورهای مغناطیسی لحظه ای هیدروژن بدن در راستای میدان و هم جهت با میدان قرار می گیرند و نسبت به تعداد کمتری که در خلاف جهت میدان قرار می گیرند، پایدارتر هستند. نحوه حرکت گشتاورهای مغناطیسی در میدان مغناطیسی مطابق معادلهBloch است:
که ضریب ژیرومغناطیس،H میدان مغناطیسی موثر،۰M بردارمغناطیسی شوندگی اولیه در حالت تعادل و۱T ،۲T زمان های بازیابی تعادل وM بردار مغناطیس شوندگی هستند. اگر پاسخ دائمی معادلهBloch را در حضور میدان مغناطیسی ثابت۰H به دست آوریم، به پدیده ای به نامPrecession می رسیم و در می یابیم که بردار مغناطیس شوندگی در حضور میدان مغناطیسی۰H با فرکانس ثابتی دوران می کند که این فرکانس به فرکانس لارمور معروف است و مقدارآن از رابطه به دست میآید. با تبدیل فرکانس زاویه ای به فرکانس، میتوان فرکانس لارمور را برای دستگاههای مختلف با میادین مغناطیسی مختلف از رابطه زیر به دست آورد :
مطابق قانون تشدید یا رزونانس، هرگاه یک دیاپازون با فرکانسی نوسان کند، تنها دیاپازونی تحریک می شود که خود قادر به تولید همان فرکانس باشد، از این قانون استفاده شده و دستگاه ، موج RF ای با همان فرکانس لارمور، ارسال می کند و این موضوع سبب تحریک گشتاور مغناطیسی لحظه ای و تغییر محور چرخش آنها می شود. حال اگر این پالسRF تحریک بر داشته شود این گشتاورها به حالت اولیه باز می گردند و همانند قبل تحت تاثیر میدان مغناطیسی قرار خواهند گرفت و این بازگشت در میدان مغناطیسی سیگنال های پاسخی را آزاد می کند که از دریافت و پردازش آنها میزان آب بدن (یون هیدروژن) در نواحی تحت پردازش قرار گرفته (که در مرکزمگنت قرار گرفته است)، مشخص شده و تمایز بین بافت های نرم، که هدف اصلی دستگاهMRI است، برآورده می شود.
اولین دستگاه MRI درسال۱۹۷۷میلادی توسط دامادین و همکارانش ساخته شد و امروزه به یکی از پیشرفته ترین و گران ترین تجهیزات پزشکی تبدیل شده است. از قسمت های مختلف یک دستگاهMRI میتوان به مگنت، بخش کنترل، فرستندهRF، گرادیان ها، کویل های گیرنده و کامپیوتر بازسازی تصاویر اشاره کرد. در سالهای اخیر تغییرات و پیشرفتهایی در این نوع سیستم ها صورت گرفته که عمده این تغییرات به نرم افزار یا اصطلاحا به کاربردهای آنها خلاصه می شود.
کنگره های انجمن رادیولوژی امریکای شمالی Radiological Society of North America یا()RSNA این امکان را فراهم می سازد تا سازندگان تجهیزات ودستگاههای MRI آخرین پیشرفتهای خود را به نمایش بگذارند. در سال گذشته بزرگترین کمپانی های سازنده MRI جدیدترین پیشرفتهای خود را در این زمینه به معرض نمایش قرار دادند که همان گونه که پیشبینی می شد، بیشترین تمرکز در زمینه کاربرد دستگاههایMRI بهویژه در ارتباط با تصاویر سه بعدی با رزولوشن بالا، تصویربرداری قلبی و تصاویرdiffusion بدن بود.
در کنار عرضه این پیشرفتها محصولات جدیدی نیز عرضه شده بود که با ساده کردن تصویربرداری و امکان پردازش ثانویه تصاویر، سرعت دستگاه و تعداد پذیرش بیماران را افزایش داده و علاوه بر این که بیمار احساس راحتی بیشتری می کند، باعث صرفه جویی در وقت نیز می شود.
به علاوه الگوریتمهای جدید ارائه شده تکنیک های تصویربرداری موازی را نیز ارتقا دادند. کویل های جدید برای قسمت های مختلف بدن عرضه شده بودند که هماهنگ با سیستم هایRF با تعداد کانال های متفاوت هستند.
(Integrated Parallel Acqusition Technique)iPAT یا تصویربرداری موازی ابزاری پویا است که امروزه نقش اساسی در تصویربرداری کلینیکی MRI ، بازی می کند. پیشرفت درiPAT جهت آشکارکردن و کشف روش هایی جدید همچنان ادامه دارد. نکته قابل توجه این است که باگذشت اندکی از عمرiPAT ، تغییرات بسیاری را در زمینه پروتکلهای تصویربرداری ارائه کرده است که ما را وادار کرده به صورت مداوم از آن استفاده کنیم.
iPAT شیوه ای جدید برای تصویربرداری سریع تر است.در این روش با استفاده ازArray Coil ها و تعداد بیشتری کانال هایRF مستقل و اطلاعات مربوط به حساسیت کویل های گیرنده، زمان تصویربرداری کاهش داده می شود.یکی از مهم ترین عوامل موثر برزمان تصویربرداری MRI ، تعداد گام هایان کدینگ فازی است که تاثیر مستقیم نیزبر رزولوشن دارد بدین معنی که یک تصویر با ماتریس ۲۵۶*۲۵۶ به ۲۵۶ نمونه برداری نیازمند است و اگر تعداد نمونه برداری ها نصف شود باعث نصف شدن زمان در ازای پایین آمدن رزولوشن تصویر می شود. با کمک iPAT میتوان با تعداد نمونه برداری های کمتر رزولوشن مورد نظر را به دست آورد. بدین ترتیب که در تصویربرداری معمولی پیش از هر نمونه برداری توسط یکی از گرادیان ها عملان کدینگ فازی ، صورت می پذیرد تا نقاط مختلف از نظر فاز از یکدیگر متمایز شوند. هنگامی که المانهای کویل در جهتان کدینگ فازی قرار گرفته باشند، عملان کدینگ میتواند با استفاده از تفاوت حساسیت المانهای کویل صورت پذیرد و سبب کاهش فعالیت گرادیانان کدینگ فازی کاهش شود. البته فعال سازیPhase over sampling باعث کم شدن اثرiPAT شده و اگرPhase over sampling وجود نداشته باشد زمان تصویربرداری تقریبا به نسبتPAT factor پایین میآید که این فاکتوردر تصویربرداری ها حداکثر۱۶ در نظر گرفته می شود.iPAT به زبان ساده همان تکنیک ثابت نگاه داشتن رزولوشن در عین کاهش زمان است.مانند همیشه درMRI پارامترها با همTrade off دارند و اعمالiPAT باعث کاهش سیگنال به نویز به نسبت ریشه دومPAT factor خواهد شد. در تکنیکی به نام GRAPPA اطلاعات از هر coil به تعداد کمتر گرفته می شود و سپس با استفاده از الگوریتم بازسازی تصویرGRAPPA واطلاعات حساسیت کویل ها، خطوط میانی نمونه برداری نشده محاسبه و جایگزین می شوند و K-space تکمیل میشود . سپس با اعمال FFT روی این فضا، تصویر نهایی بازسازی می شود.
درتکنیکmSENSE نیز نمونه برداری ها با تعداد خطوط کمتری صورت می پذیرد و با اعمال FFT تصویر هریک به صورت مجزا تشکیل می شود سپس با کمک الگوریتم mSENSE و با استفاده از اطلاعات حساسیت کویل ها، تصویر نهایی ساخته میشود. از آنجا که نمونه برداری های کمتر باعث به وجودآمدن آرتیفکتFold over یا aliasing میشود در تصویر برداری هایی که تصویر نهاییaliasing دارد نمیتوان از این تکنیک بهره گرفت چراکه الگوریتم، قابلیت تمایز بین سیگنال های اصلی وaliasing را ندارد. معمولا در تصویربرداری های باFOV کوچک این مشکل وجود دارد و بهتر است که از تکنیکGRAPPA کمک گرفته شود . پیش از معرفی iPAT تنها روش سرعت بخشیدن به تصویربرداری ها استفاده از گرادیان های سریعتر بود و با توجه به محدودیت های فیزیولوِِِژیک، حداقل زمانهای تصویربرداری قابل کاهش نبود، اماiPAT این مشکل را حل کرده و زمان را با کاهش گام هایphase encoding کاهش داده است. استفاده ازiPAT محدودیت هایی نیز دارد، به طور مثال کویل های گیرنده بایدarray باشند و کویل هایsingle مانندflex به تنهایی این قابلیت را دارا نیستند. ضمنا المان های انتخاب شده کویل های گیرنده باید در امتداد جهتان کدینگ فازی قرار گرفته باشند و تعداد آنها است که حداکثر مقدار PAT factor را تعیین می کند. از لحاظ سخت افزاری نیز هر المان کویل باید به یک کانالRF مجزا متصل شده باشد.
از مزایای کاربردی و دیگرiPAT میتوان به افزایش رزولوشن تصویر در زمان های برابر اشاره کرد، همچنین در تصویربرداری های مغز و گردن diffusion prefusion EPI HASTE() آرتیفکت را کاهش داده و اعوجاج را از بین می برد. در تصویربرداریAbdominal Truefisp( ،HASTE ،)VIBE با کاهش زمان حبس تنفس، باعث راحتی بیشتربیمار و افزایش سرعت تصویربرداری می شود و نیز با کاهش آرتیفکت های حرکتی، تصاویر واضح تری را به وجود می آورد. در تصویربرداری های قلبی (Cardiac) و عروقی(آنژیوگرافی) نیز مزایایiPAT قابل بهره برداری است. البته نکاتی در رابطه با استفاده ازiPAT نیز وجود دارد : به طورمثال هنگام استفاده ازکویل مغز ۸ کانال بایستی از فیلترنرمالیزه کننده استفاده کرد تا بتوان تصویر یکنواختی به دست آورد. همچنین در تصویربرداریaxial از شکم، تکنیک SENSE تصویر بهتری میدهد در صورتی که معمولا استفاده ازSENSE باعث نویز بیشتر در پس زمینه تصویر می شود. البته استفاده از پدهای فاصله انداز بین کویل و بدن را نباید فراموش کرد.
در پروتکلهایsingle shot مانند HASTE وEPI استفاده ازGRAPPA علاوه بر این که اعوجاج و آرتیفکت ها را کاهش میدهد امکان تصویربرداری با TE کمتر را نیز فراهم میسازد.
به عنوان یکی از پیشرفتهایiPAT میتوان به۲iPAT اشاره کرد که در تصویربرداری سه بعدی استفاده می شود. در تصویربرداری سه بعدی عملان کدینگ فازی در دو جهت صورت می گیرد و به جای یکSlice از یک Slab تصویربرداری می شود، در مورد۲iPAT ، عملان کدینگ فازی در جهتSlice ها اعمال می شود و در صورتیکه تعداد المان های کویل در این جهت از یکبیشتر باشد، در این جهت نیزiPAT میتواند به کار رود. فاکتورPAT نهایی برابر با حاصلضرب فاکتورهایPAT در دو جهتان کدینگ فازی است که یکی فاکتورPE و دیگری فاکتورD۳ نامیده می شود. ازجمله پروتکل هایی که از این روش استفاده می کنند میتوان بهGre وd-ce۳fl وd-vibe۳fl وtrufi اشاره کرد. البته در جهت اسلایس ها فقط به صورتGRAPPA میتوان ازiPAT استفاده کرد و محدودیت های دیگری نیز از جمله درFAT SAT یا استفاده همزمان ازover sampling ،فوریه جزئی به وجود میآورد.
استفاده از کویل های ماتریسی که درتکنولوژیTIM مورد استفاده قرار می گیرند در سه حالCP ،dual ،triple قابل انجام است و در حالتTriple هر سه المان کویل به صورت مستقل عمل می کنند و به سه کانال مجزایRF متصل می شوندکه سبب می شوند بهترین بازدهی ازiPAT به دست آید. از سوی دیگر قابلیت انعطاف بیشتری در انتخاب جهت انکدینگ فازی فراهم می کند و به همین جهت در تصویربرداری های سه بعدی به خوبی مورد استفاده قرار میگیرند.
● توجه به نکات ذیر در رابطه با iPAT توصیه میشود :
۱) المان های کویل درجهتانکدینگ فازی قرار گرفته باشند.
۲) به تعداد لازم حداقل برابر با فاکتورPAT از المان های کویل انتخاب شده باشند.
۳) فاصله بین کویل و بدن از حداقل لازم برخوردار باشد بهویژه در شکم،قلبو آنژیو .
۴)در پروتکلهای single shot مانندEPI استفاده ازiPAT باعث بهبود کیفیت می شود و روی زمان تصویربرداری اثری ندارد.
۵) کاهش سیگنال به نویز بایستی مورد توجه قرار گیرد و در برخی موارد جبران سازی شود.
۶) هنگام استفاده ازmSENSE بایستی مطمئن شد که در جهتانکدینگ فازی به اندازه کافیFOV بزرگ انتخاب شده باشد و در صورت نیاز ازPhase over sampling استفاده شود.
۷) هنگام استفاده ازiPAT با پروتکلهای GRE (گرادیان اکو) استفاده از حالت چند پاسخی(Multi echo) امکان پذیر نیست.
منبع : ماهنامه تخصصی مهندسی پزشکی
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
ایران سریلانکا حجاب رهبر انقلاب کارگران دولت پاکستان مجلس شورای اسلامی رئیسی سید ابراهیم رئیسی رئیس جمهور دولت سیزدهم
سیل کنکور تهران شهرداری تهران هواشناسی فضای مجازی پلیس سلامت فراجا قتل وزارت بهداشت قوه قضاییه
قیمت خودرو خودرو بازار خودرو قیمت دلار قیمت طلا دلار بانک مرکزی ایران خودرو بورس سایپا تورم قیمت سکه
تلویزیون سریال مهران مدیری کتاب تئاتر فیلم سینمایی سینمای ایران رادیو شعر سینما انقلاب اسلامی نمایشگاه کتاب
دانشگاه فرهنگیان
رژیم صهیونیستی اسرائیل غزه آمریکا فلسطین روسیه جنگ غزه چین طوفان الاقصی عملیات وعده صادق ترکیه اتحادیه اروپا
فوتبال پرسپولیس استقلال باشگاه پرسپولیس باشگاه استقلال فوتسال بازی تراکتور تیم ملی فوتسال ایران رئال مادرید بارسلونا لیگ برتر
هوش مصنوعی مریخ ناسا فیلترینگ تسلا تبلیغات ایلان ماسک اپل وزیر ارتباطات فناوری نخبگان سامسونگ
سلامت روان داروخانه دوش گرفتن یبوست