یکشنبه, ۱۶ اردیبهشت, ۱۴۰۳ / 5 May, 2024
مجله ویستا
بیماری آنگارا (سندرم آب آوردگی پریکارد و هپاتیت)
سندرم آب آوردگی پریكارد و هپاتیت (HHS) یك بیماری عفونی و مسری است كه از علائم مشخصه آن درصد ابتلا و درصد تلفات بالا است . مایعات پریكارد افزایش یافته و هپاتیت با كانونهای نكروزی زیادی دیده می شود. علت اختصاصی این سندرم آدنو ویروس گروه یك می باشد.
بعضی از عوامل و شرایط فارم باعث افزایش شدت بیماری می شوند. امكان تداخل این بیماری با بیماریهای مضعف سیستم ایمنی مانند گامبورو و مارك و كم خونی عفونی جوجه ها تأیید نشده است ولی اعتقاد بر این است كه اثر این بیماریها در بروز بیماری آنگارا مهم می باشد.برآورد اقتصادی بیماری آنگارا مشكل است بدلیل اینكه در مناطقی كه این بیماری بروز می كند ممكن است همراه با سایر بیماریهای طیور از قبیل نیوكاسل ولوژنیك – مایكوپلاسموزیس – سالمونلوزیس – مارك و آنفلوآنزا باشد.
میزان شیوع و شدت بیماری (HHS) بستگی به تراكم مرغداریها در منطقه دارد. سندرم آب آوردگی پریكارد و هپاتیت اولین بار در سال ۱۹۸۷ در منطقه آنگارا در نزدیكی كراچی تشخیص داده شد . بدلیل اینكه بیماری (HHS) در این منطقه جغرافیایی بخصوص تشخیص داده شد به آن بیماری آنگارا گفته میشود. جوجه های گوشتی در سن ۳تا۵ هفتگی حساس هستند. این بیماری در مرغهای مادر نابالغ و مرغان تخمگذار تجارتی هم مشاهده می شود.
● سبب شناسی:
در ابتدا علت بیماری (HHS) به یك مسمومیت ویا اختلا ل تغذیه ای نسبت داده می شد. از طریق تزریق كبد هموژن شده طیور آلوده به جوجه های گوشتی ثابت شد كه علت بیماری یك عامل عفونی است. در مشاهدات بعدی در سلولهای كبدی گنجیدگی داخل هسته ای بازوفیلیك مشاهده گردید .
در نتیجه سعی شد یك عامل ویروسی جدا گردد. در سال ۱۹۸۸ مشخص شد كه یك آدنوویروس عامل این بیماری است. بوسیله میكرسكوپ الكترونی (EM) از كبد هموژن شده می توان برای مشخص كردن نشانه های اختصاصی ویریون ها استفاده كرد. كبد و ریه اخذ شده از پرندگان آلوده زمانی كه با آنتی سرم اختصاصی آدنوویروس مجاور شود در آزمایش آگار ژل مثبت می گردد. بافت كبد هموژن شده و تصفیه شده از پرندگان آلوده را به داخل پرده كوریونیك و كیسه زرده تخم مرغهای SPF در سن ۸ روزگی جنینی تزریق می گردد جنین ۴ تا ۷ روز بعد تلف میشود. مطالعات در سال ۱۹۹۱ نشان داد كه جهت غیر فعال كردن سوسپانسیون كبد بوسیله اتر یا كلروفرم آدنوویروس ها غیر فعال نمیشوند ولی محدود می گردند.
تهیه سوسپانسیون كبد از پرنده آلوده و نگهداری آن در درجه حرارت ۶۰ درجه سانتی گراد درمدت ۳۰ دقیقه سبب غیر فعال شدن آدنو ویروس می گردد. ظاهرا" مقاومت حرارتی مختلفی در بین آدنو ویروسها وجود دارد. زمانی كه كبد هموژن شده را با ۴۵۰۰۰ دور بمدت ۹۰ دقیقه سانتریفوژ كنند ذرات معلق شده بیماریزا بوده ولی مایع رو فاقد قدرت عفونت زائی است.
افزودن آدنوویروس ایجاد كننده هپاتیت با گنجیدگی داخل سلولی به مایع رو موجب احیاء قدرت عفونت زائی آن می گردد. كه این امر نشان دهنده حضور یك عامل ویروسی مجزا بغیر از آدنو ویروس اولیه می باشد.
از مطالعات بعدی در مكزیك كه در سال ۱۹۹۴ انجام شد چنین استنباط می گردد كه بعلت عدم مهار توسط ۵- برومو دی اكسی یوریدین یك ویروس RNA بعنوان عامل اضافی مطرح می باشد. این عامل سبب بروز یك حباب كوچك در كشت سلولهای كبد وكلیه جوجه می گردد.
پیچیدگی بیشتری در تعریف اتیولوژی این بیماری وجود دارد زیرا در مناطقی كه بیماری (HHS) وجود دارد بیماریها با پاتوژنیسته زیاد از قبیل گامبور و كمخونی عفونی جوجه ها نیز دیده می شود.
ویروس عامل این بیماری از كبد هموژن شده گله های آلوده در پاكستان جدا شده است. عامل آن آدنوویروس گروه یك سروتیپ ۴ تا۱۱ می باشد.
اخیرا" بیماری (HHS)بصورت آزمایشی بوسیله آدنوویروس طیور سروتیپ های ۴(STRAIN PARC-۱) و ۸(STRAIN DCV-۹۴) در جوجه ها ایجاد شده است . در جوجه های حساس بعد از آلودگی ، گنجیدگی های داخل سلولهای كبد و هم آب آوردگی پریكارد مشاهده می شود. سروتیپ ۴ آدنوویروس به بافت لنفوئیدی تمایل دارد در نتیجه ضعف سیستم ایمنی ایجاد می گردد. تضاد اختلاف بین فرضیه های تك ویروسی و دو ویروسی پس از انجام مطالعات اپیدمیولوژی و آزمایشگاهی رفع خواهد شد.
● بیماریزایی و اپیدمیولوژی:
▪ میزبانهای آزمایشگاهی و طیبعی:
جوجه های نابالغ میزبانهای طبیعی هستند . بیماری(HHS) بیشتر در سنین بین ۳ تا ۵ هفتگی در جوجه های گوشتی مشاهده می شود. یك بیماری شبیه (HHS) در كبوتر ها در پاكستان گزارش شده است.
▪ انتقال:
عامل بیماری (HHS) كه مورد بحث می باشد آدنوویروس گروه یك است و انتقال آن هم عمودی و هم افقی است. آدنوویروس در گله های مادر تا زمان بلوغ باقی می ماند و در اثر ضعف سیستم ایمنی و یا استرس دفع میگردد. جوجه هایی كه از گله های مادر آلوده تولید می شوند بعد از ۳ هفتگی ممكن است ویروس را تا ۱۴ هفته دفع كنند.
انتقال افقی ویروس در گله هایی كه چند سنی هستند و در گله هایی كه مسائل بهداشتی را رعایت نمی كنند رخ می دهد. تكثیر ویروس در دستگاه گوارش انجام می شود. آلودگی مدفوعی لباس ، كفش و وسائل ( از قبیل ظروف و وسائل نقلیه) ممكن است باعث انتقال عامل بیماری شوند. در گله های طیور در پاكستان به دلیل عدم وجود مسائل بهداشتی و وجود فارمهای بسته چند سنی و وجود پرندگان بومی عامل بیماری انتقال پیدا میكند. واكسنهایی كه از جنین های آلوده تهیه می شود ممكن است منشا" آلودگی باشد.
یك مطالعه در مورد عوامل خطر ایجاد بیماری HHS در گله های گوشتی در پاكستان انجام شده است. ورود واكسیناتورها به فارمها ،گله ها را به شیوع بیماری حساس می نماید. میزان آلودگی از طریق تزریقات زیر جلدی و یا داخل عضله برابر با آلودگی طیبعی از طریق هوا ، آب و یا مدفوع میباشد.
● علائم و درصد ابتلا و درصد تلفات
در مجاورت اسلام آباد پاكستان از ۱۳۱ گله كه دارای ۱۳۵ واحد نیمچه گوشتی بودندیك شیوع ۴۶ درصدی گزارش شده است. درصد تلفات ناشی از این بیماری در گله های نیمچه گوشتی غیر واكسینه و گله های مادر نابالغ اگر با بیماری نیوكاسل ولوژنیك و بیماری گامبورو با پاتوژنیسته بالا و بیماریهای اروزیو مانند مایكوپلاسموز همراه باشد بیشتر از ۸۰ درصد است. معمولا" دوره عفونت بین ۹ تا ۱۴ روز است، درصد ابتلا ۱۰ تا ۳۰ درصد بوده و روزانه ۳ تا ۵ درصد تلفات وجود دارد. در شرایط آزمایشگاهی كبد هموژن شده ای كه از گله آلوده اخذ شده را به تعدادی جوجه تزریق كرده اند.تلفات ۲ تا ۴ روز بعد ایجاد شده ، درصد تلفات ۳۰ تا ۷۰ درصد بوده و بستگی به میزان تیتر عامل بیماری داردكه جوجه ها دریافت داشته اند.گله هایی كه بیماری HHS را نشان می دهند دارای علایم كلینیكی اختصاصی نیستند .
شروع ناگهانی تلفات ، بی حالی ، ازدحام كردن ، پرهای ژولیده وزرد و ریزش موكوئید از علائم مشخصه آن است . در طیور مبتلا میزان هموگلوبین و PCV و اریتروسیت ها و مجموعه لوكوسیت ها كاهش پیدا می كند. در اثر استرس و عفونت های ویروسی لنفوسیت ها كاهش و هتروفیل ها افزایش پیدا می كنند. در طیور بیمار به دلیل تخریب كبد پروتئین خون و آلبومین كاهش پیدا می كند این مسئله احتمالا" دلیل افزایش هیدروپریكاردیوم می باشد. اگراین بیماری با كم خونی شدید بروز كند معمولا" توأم با بیماری كم خونی عفونی جوجه ها ویا گامبورو با حدت بالا است. در پرندگان بیمار میزان لاكتیك دهیدروژناز ، آلكالین فسفاتاز و آلانین ترانس آمینازكه بواسطه تخریب كبد و كلیه ایجاد میگردند افزایش می یابند.
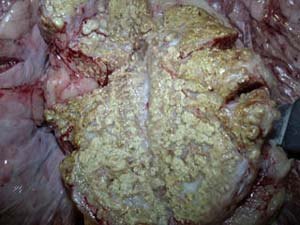
مهمترین ضایعه پس از مرگ كه بر روی لاشه دیده می شود وجود بیش از ۱۰ سی سی محلول ترانسودای شفاف در كیسه اطراف قلب می باشد. در لاشه پر خونی عمومی و ادم ریه وجود دارد. كبد و كلیه ها بزرگ و رنگ پریده و ترد و شكننده می گردند. در شرایط آزمایشگاهی در طیور بیمار نكروز میوكارد و كبد مشاهده می شود. خونریزی پتشی ممكن است بر روی پریكارد و كپسول كبد دیده شود. ضایعات بافتی در قلب شامل ادم و دژنرسانس و نكروز ملایم عضله قلب و نفوذ سلول های منونوكلئار و خروج اریتروسیت ها است . در كبد اینكلوژن بادی بازوفیلیك در داخل هسته های هپاتوسیت و نفوذ سلول های منو نوكلئار و نكروز انعقادی چند كانونی وجود دارد. ممكن است در منطقه وسیعی از بافت اپی تلیوم كلیه نیز نكروز دیده شود.
● تشخیص:
آب آوردگی پریكارد همراه با گنجیدگی های بازوفیلیك داخل هسته ای سلولهای كبد دال بر وجود بیماری HHS است. تشخیص قطعی براساس جدا سازی آدنو ویروس از سلولهای كبد جنین جوجه های آلوده می باشد. این روش حساس تر از روش تزریق به كیسه زرده جنین جوجه ۸ روزه است. بوسیله آزمایشات سیتوپاتولوژی می توان در كشت بافتی وجود آدنوویروس را تشخیص داد. آدنو ویروس ها را می توان بوسیله میكرسكپ الكترونی(EM) و یا سرم نوترالیزیشن تشخیص داد
● درمان:
درمان اختصاصی برای این بیماری وجود ندارد. ولی در زمان بروز بیماری از یدوفور در آب آشامیدنی به میزان ۱/۰ تا ۰۷/۰ درصد استفاده می شود. درصد تلفات و شدت بیماری كاهش پیدا خواهد كرد.
● پیشگیری و كنترل:
در پاكستان وهند و مكزیك حفظ شرایط بهداشتی نه عملی است و نه اقتصادی است ومسلما" آدنوویروس از واحدهای نیمچه گوشتی جدا خواهد شد.علل ایجاد بیماری عبارتنداز:چند سنی بودن گله ، فروش پرندگان زنده، انتقال غذا بوسیله كیسه ها و افرادی كه پرندگان اهلی را نگه داری میكنند.
گله های مادر باید بوسیله رعایت شرایط بهداشتی مناسب از عفونت محافظت شوند. فاصله فارم های صنعتی از یكدیگر باید حداقل ۲ كیلومترباشدوازسیستمALL IN- ALL OUT در پرورش استفاده شود تا ازآلودگی فارم های سالم جلوگیری بعمل آید.مواد غذایی باید بصورت عمده نگهداری شوند و قبل از ورود آن به فارم هیچكس نباید با مواد غذایی تماس داشته باشد.در گله های مادر و جوجه های آن از واكسن زنده استفاده میشود.
واكسنها می بایست بر اساس استانداردهای بین المللی تولید گردند و باید عاری از عوامل پاتوژن از قبیل آدنوویروسها و ویروس كم خونی عفونی طیور باشد. در مناطقی كه بیماری HHS اندمیك می باشد ضروری است گله ها را در برابر آدنوویروس اولیه كه مسئول ایجاد این بیماری است محافظت كرد. واكسن كشته فرم آلدئید كه از كبد هموژن شده تهیه میگردد گله های گوشتی را در پاكستان محافظت كرده است . واكسن مناسب از كبد هموژن شده جوجه SPF كه بوسیله فرم آلدئید ۱/۰ درصد غیر فعال شده تهیه می گردد.
اثر این واكسن در یك منطقه كه دارای ۲۸ گله با ظرفیت ۱۰۰۰۰۰ قطعه نیمچه گوشتی می باشد مورد مطالعه قرار گرفته است. گله هایی كه واكسینه شده اند و بصورت طبیعی در معرض آلودگی قرار گرفته اند بیماری HHS راكمترنشان می دهند تلفات آن به ۲/۱ درصد میرسد. گله هایی كه واكسن دریافت نكرده اند تلفات آنها بالغ بر ۲۰ درصدمی باشد. پس از واكسیناسیون در منطقه راولپندی در یك میلیون قطعه نیمچه گوشتی درصد تلفات تقریبا" به ۴ درصد رسیده است و در گله های غیر واكسینه تلفات ۳۱ درصد می باشد.
در مكزیك در یك ارزیابی آزمایشی بر روی ۵ نوع واكسنی كه بصورت تجارتی تولید گردیده نشان داده شد كه واكسن غیر فعال فرمالینه در امولسیون روغنی گله هایی را كه به صورت طبیعی درمعرض بیماری بوده اند را ۱۰۰ درصد محافظت می كند و ضایعات هستوپاتولوژی در آنها وجود ندارد.میزان محافظت ۴ واكسن غیر فعال دیگر كه از سویه DCV-۹۴ تهیه شده در گله هایی كه با ویروس فیلد برخورد داشته اند بین صفر تا ۴۵ درصد است. در جوجه هایی كه واكسن دریافت نكرده اند تلفات به ۸۰ درصد می رسد.
در همه جوجه هایی كه واكسینه شده اند آنتی بادی بوسیله مهار ایمینوفلورسانس مشخص می گردد. پس از واكسیناسیون جوجه ها بر علیه بیماری HHS پاسخ ایمنی مناسبی ایجاد می شود و زمانی كه گله با عامل بیماری برخورد می كند جوجه ها زنده می مانند.
نویسنده : دكتر داریوش خسروی
منبع : اردلان آنلاین
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
تعمیر جک پارکینگ
خرید بلیط هواپیما
حسین امیرعبداللهیان لبنان وزیر خارجه دولت سیستان و بلوچستان جنگ انتخابات مجلس شورای اسلامی حجاب دولت سیزدهم مجلس حسن روحانی
سیل تهران یسنا هواشناسی شهرداری تهران بارندگی سازمان هواشناسی باران فضای مجازی آتش سوزی هلال احمر آموزش و پرورش
هوش مصنوعی خودرو دلار قیمت خودرو قیمت دلار بانک مرکزی قیمت طلا تورم مسکن بازار خودرو حقوق بازنشستگان ایران خودرو
تلویزیون جهان صدا و سیما مهران غفوریان موسیقی صداوسیما سریال سینمای ایران سازمان صدا و سیما
غزه رژیم صهیونیستی فلسطین اسرائیل جنگ غزه حماس آمریکا ترکیه انگلیس اوکراین نوار غزه امیرعبداللهیان
فوتبال پرسپولیس رئال مادرید استقلال سپاهان لیگ برتر باشگاه استقلال بازی باشگاه پرسپولیس علی خطیر جواد نکونام بایرن مونیخ
اینستاگرام اپل ناسا عکاسی تبلیغات موبایل گوگل
کبد چرب فشار خون