جمعه, ۷ اردیبهشت, ۱۴۰۳ / 26 April, 2024
مجله ویستا
مواد آمبولیزه کننده مورد استفاده در آمبولیزاسیون فیبروئید رحم ( UFE )
فیبروئید رحم تومور بسیار شایع در سیستم تولید مثل زنان می باشد و به طور تقریبی در ۴۰% از زنان یائسه بالای ۵۰ سال ایجاد می شود .
اکثر فیبروئیدها بدون علائم بالینی هستند ، ولی بعضی از بیماران مبتلا ، از خونریزی های غیر طبیعی رحم ، درد لگن ، بادکردگی شکم ، فشار برروی مثانه و تکرر ادرار و درد در حین مقاربت شکایت دارند .وجود یک یا چند مورد از این علائم کافی است تا بیمار کاندید انجام آمبولیزاسیون فیبروئید رحم ( UFE ) شود .
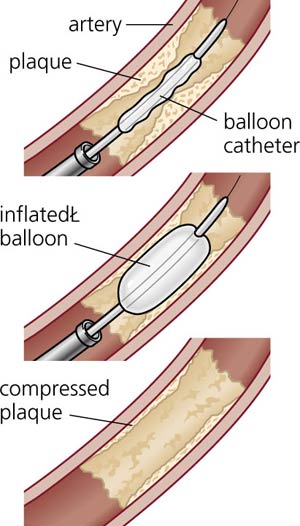
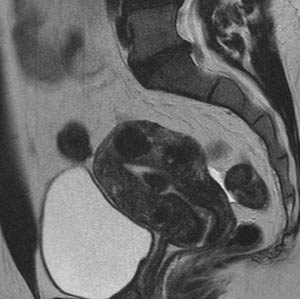
تکنیک و مواد مورد استفاده برای UFE توسط رادیولوژیست مشخص می گردد . به محض مشخص شدن روش کار ، از طریق شریان فمورال مشترک ، شریانهای راست و چپ رحم به طور سلکتیو کاتتریزه می شوند . سپس مواد آمبولیزه کننده درون عروق تزریق شده و منجر به انسداد عروق شده و فیبروئید رحم به تدریج تحلیل می رود . ( شکل ۱ )
A . آرتریوگرام DSA از لگن ، شریانهای گشاد شده و پیچیده رحم را که فیبروئید هایپرواسکولار را تغذیه می کند نشان می دهد .
B. آرتریوگرام سلکتیو از شریان سمت راست رحم نمای هایپرواسکولار فیبروئید
را نشان می دهد .
C. آرتریوگرام لگن بعد از آمبولیزاسیون دو طرفه شریان رحم با PVA (&#۹۵۶;۵۰۰-۳۵۰ ) .
فقدان جریان خون را در شریانهای سمت راست و چپ رحم نشان می دهد.
D و E . تصاویر ساژیتال MR ( Fast inversion recovery ) تهیه شده قبل از (D) و
بعد از (E) آمبولیزاسیون دوطرفه شریانهای رحم . قبل از آمبولیزاسیون اندازه
رحم ۷* ۵/۵ *۱۰ سانتی مترو فیبروئید ۶/۴ * ۵/۴ * ۵/۴ سانتی متربود.بعد
از آمبولیزاسیون شدت سیگنال فیبروئید کاهش یافته و %۶۹ کاهش در حجم
فیبروئید غالب ایجاد شده است .
پلی ونیل الکل ( polyvinyl alcohol ) یا PVA به عنوان یکی از مواد آمبولیزه کننده به طور وسیع به کار می رود .
بعضی از تحقیقات نیز نشان می دهد که می توان از Gel foam ( ژل فوم ) به عنوان یکی دیگر از مواد آمبولیزه کننده استفاده کرد ( Pharmacia and Upjohn , Kalamazoo , MI ) زیرا استفاده از آن با موفقیت همراه بوده و رحم ، توانایی بارداری را بعد از آمبولیزاسیون حفظ می نماید .
اکثر رادیولوژیست های اینترونشنیت آزمون UFE را به عنوان قسمتی از کارهای روزانه خود قرار داده اند . هم بیماران و هم متخصصان زنان به دنبال کسب اطلاعات درباره آمبولیزاسیون هستند . آنها اغلب سؤالاتی درباره سابقه کاربرد مواد آمبولیزه کننده ، رابطه موفقیت های کلینیکی UFE با مواد آمبولیزه کننده انتخاب شده ، مشکلات بالقوه مرتبط با انجام آزمون و مواد آمبولیزه کننده دارند .
بدین منظور ، مطلب زیر برای پاسخ به این سؤالات و دیگر سؤالات درباره کاربردهای سابق و اخیر PVA و ژل فوم در درون بدن ، مخصوصاً در لگن به منظور انجام UFE و دیگر درخواستها گرد آورده شده است .
Polyvinyl Alcohol ( PVA )
در ابتدا این ماده به خاطر کاربردش در اسفنج های مورد مصرف خانگی و دیگر مصارف خانگی و صنعتی شناخته شده بود . همچنین زیست سازگاری (biocompatibility) پلی ونیل الکل در اولین کاربرد پزشکی آن ثابت شد .Glaggett and Grindlay این ماده را به عنوان یک ماده پرکننده بعد از pneumonectomy استفاده کردند . از آن پس این ماده در بیمارانی که سوختگی داشتند به عنوان جانشینی برای پوست ، در بیماران با پرولاپس رکتوم ، و برای نقصهای قلبی مثل تترالوژی فالوت ( Tetralogy of fallout ) بکارمی رفت . در این محیط ، PVA به آسانی با بافت ترکیب شده و درون بافت رشد یافته قرار می گیرد .
آماده کردن PVA برای استفاده به عنوان ماده آمبولیزه کننده بدین صورت است که ابتدا به صورت یک اسفنج که قدرت جذب آب را دارد و می تواند فشرده شود، در می آید . تا زمانیکه اسفنج خشک است به شکل فشرده باقی می ماند ، اما زمانیکه در محیط مایع قرار گرفت به شکل و حالت اولیه خود باز می گردد . با ساییدن اسفنج محتوی PVA ، تکه ها و ذرات کوچک بدست می آید . برای بدست آوردن سایزهای کوچک و متنوع ، این اسفنج ها از صافیهای با سوراخهای کوچک در سایزهای متفاوت عبور داده می شوند .
یکی از مشکلات بالقوه در این روش این است که ممکن است اشکال نا منظمی از ذرات PVA که اندازه های بزرگی دارند با توجه به جهت عبورشان از سوراخهای کوچک صافی عبور کنند ( عرض کم و طول زیاد ) . این مسئله باعث تولید ذرات در شکلها و اندازه های گوناگون می شد . در نهایت تغییراتی در فرایند تولید این ذرات داده شد تا از یکنواختی اندازه آنها اطمینان حاصل شود .
اولین استفاده موفقیت آمیز PVA به عنوان یک ماده آمبولیزه کننده توسط Tadavarthy و همکارانش گزارش شده است . در دو مطالعه بر روی بیماران با کارسینومای سرویکال ، همانژیوسارکومای کبد ، همانژیواندوتلیومای گردن و پیشانی ، و مالفورماسیون شریانی _وریدی ( AVM ) .
از آن پس PVA به طور موفقیت آمیز برای آمبولیزاسیون عروق در بیمارانی با بیماریهایی مثل AVM های سر و گردن و تومورها ، خونریزی های قسمت تحتانی دستگاه گوارش ، نئوپلاسمای کبدی ( hepatic neoplasm’s ) ، متاستازهای استخوان به دنبال رنال سل کارسینوما و هموپتیزیز ( hemoptysis ) بدلیل کیستهای فیبروزی به کار رفت .
قبل از استفاده از PVA در آزمونهای UFE ، از آن به طور معمول در آمبولیزاسیون های لگن استفاده نمی شد . در مردان ، PVA به طور موفقیت آمیز در درمان priapism با جریان کم و با جریان زیاد استفاده شده است .
در زنان ، pisco و همکارانش ، استفاده از PVA را در درمان ایجاد شده به علت نئوپلاسم های لگن گزارش کردند . محققان یافتند که در مقایسه با ژل فوم (Gel foam ) ، ذرات PVA خونریزی را بهتر کنترل می کنند و پس از استفاده از آنها احتمال عود بیماری کمتر می شود .
Poppe و همکارانش ، استفاده موفقیت آمیز از ذرات PVA را در کنترل خونریزی ناشی از AVM رحم و حفظ توانایی بیمار برای حاملگی را گزارش کردند .
با توجه به پروسه بیماری و عضو درگیر ، سطح مورد نظری که بایستی آمبولیزه شود ( پروگزیمال یا دیستال ) اندازه ذرات PVA را تعیین می کند . عموماً در آمبولیزاسیون های قسمت دیستال بیشتر از ذرات با اندازه کوچکتر استفاده می شود و ریسک تحلیل قسمت انتهایی عضو افزایش می یابد . ولی تمایل ذرات PVA برای پیوستن به یکدیگر ، معمولاً باعث می شود که اندازه مؤثر بزرگتری نسبت به اندازه واقعی ذرات ایجاد شود که منجر به انسداد قسمتهای پروگزیمال در حین آمبولیزاسیون می شود . با رقیق کردن و تزریق آهسته ، تمایل ذرات برای اجتماع کاهش می یابد و در پی آن آمبولیزاسیون قسمتهای دیستال صورت می گیرد .
هنوز مناسب ترین اندازه ذرات برای استفاده در آزمون UFE تعیین نشده است اما بیشترین اندازه مورد استفاده ذراتی با قطر ۵۰۰-۳۵۰ یا ۷۱۰-۵۰۰میکرون می باشد . اثرات بافت شناسی PVA در عروق خونی آمبولیزه شده ، در طی چندین مطالعه بررسی شده است .
در بدو امر ، چسبیدن ذرات PVA به دیواره عروق باعث کاهش جریان خون می شود . در نتیجه ، باعث ترومبوز ، واکنش های التهابی ، واکنش جسم خارجی و آنژیونکروز موضعی دیواره عروق می گردد .
آنژیونکروز در جایی که ذرات PVA با دیواره عروق در تماس هستند به صورت لوکالیزه اتفاق می افتد و می تواند باعث اکستراوازیشن پری واسکولار ذرات PVA شود . ولی این اتفاق به صورت مکرر و پیوسته اتفاق نمی افتد . ایجاد واکنش جسم خارجی به PVA تا ۲۸ ماه بعد از آمبولیزاسیون گزارش شده است .
PVA توسط بسیاری از افراد به عنوان یک ماده آمبولیزه کننده دائمی معرفی شده است ، زیرا biodegradable ( تلاشی پذیر توسط عمل میکروبی ) نیست .
اثرات طولانی مدت ذرات PVA که به صورت درون عروقی به کار رفته اند توسط Davidson و Terbrugge در بیماری که مالفورماسیون عروقی صورت داشته و ۸ سال پس از آمبولیزاسیون برداشته شده بود ، مورد مطالعه قرار گرفت . در این بیمار ، هیچ مدرکی دال بر متلاشی شدن ذرات یافت نشده و تنها تغییر در مورفولوژی ذرات ، کلیسفیکاسیون خفیف بوده است . ولی ذرات PVA به طور پیوسته در نمونه های تهیه شده بعد از آمبولیزاسیون یافت نشد . بعضی از تئوریهای ارائه شده دلیل این امر را حرکت ذرات به قسمتهای دیستال می دانند . بعضی از محققان دیگر بیان کردند که یافته های مغایر ممکن است بدلیل استفاده از رنگ آمیزی E و H در هنگام آماده سازی اسلایدهای پاتولوژی ایجاد شده باشد . ذرات PVA با استفاده از رنگ Verhoeff_van Giesonبه صورت خیلی عالی دیده می شوند .
زمانهای گزارش شده برای انسداد عروقی ایجاد شده توسط ذرات PVA متغییر می باشند . بعضی از محققان گزارش کردند که انسداد کامل پس از چند ماه ایجاد می شود . انسداد دائمی با ایجاد ارگانیزاسیون ترومبوز ، از بین رفتن تراوش التهابی(inflammatory infiltrate)و نفوذ بافت به داخل ذرات که منجر به فیبروز نیز می شود ، حاصل می گردد . همین طور luminal recanalization بعد از آمبولیزاسیون با PVA هم گزارش شده است .
مکانیزم های مطرح شده برای recanalization شامل : آنژیونئوژنزیز و رشد مجدد مویرگها به علت vascular prolifration در درون ترومبوز ارگانیزه شده و جذب مجدد ترومبوز ایجاد شده بین انبوه PVA در لومن عروق آمبولیزه شده بعد از بهبود التهاب می باشد
به نظر می رسد recanalization در قسمتی از لومن عروق ایجاد می شود که قبلاً شامل ترومبوز بودند و نه در قسمتی که شامل ذرات PVA است .
مشکلاتی در رابطه با استفاده از PVA به عنوان ماده آمبولیزه کننده گزارش شده است . در سالهای گذشته وارد شدن ذرات PVA بسیار کوچک ، احتمال ریسک جراحات غیر عمدی به قسمت تحتانی عضو را افزایش می داد . مشکلات ویژه شامل : فلج اعصاب صورت بعد از آمبولیزاسیون شریان کاروتید خارجی ، فلج بعد از آمبولیزاسیون عروق برونشیال ، نکروز و فلج مثانه و عضلات لگن بعد از آمبولیزاسیون لگن و مرگ دو کودک بعد از آمبولیزاسیون AVM کبد مطرح بوده است . احتمال می رود هر دوی این مرگ و میرها به هایپرتانسیون ریه مربوط باشند و به احتمال قوی ذرات از مالفورماسیون عبور کرده و وارد گردش خون شریانی ریه شده اند .
در پاسخ به این گزارشها تکنیک های تولید برای به حداقل رساندن تعداد ذراتی که از اندازه اختصاصی PVA کوچکتر هستند ، تغییر یافتند .
● نقش PVA در آمبولیزاسیون فیبروئید رحم ( UFE )
استفاده از ذرات PVA در آمبولیزاسیون فیبروئید رحم برای اولین بار توسط Ravina در سال ۱۹۹۵ گزارش شده است .
در این مطالعه ، در ۱۶ بیمار مبتلا به فیبروئید رحم ، آمبولیزاسیون شریان رحم به عنوان درمان اولیه انجام شد . این بیماران به طور متوسط ۲۰ ماه تحت نظر بودند و در ۱۴ بیمار ، علائم بیماری کاسته شده و یا بهبود یافتند .
دو بیمار به علت وجود علائم مزمن بعد از آمبولیزاسیون نیاز به انجام عمل جراحی داشتند . از سال ۱۹۹۷ به بعد گزارشهای منتشر شده یافته های اولیه Ravina را تأیید کردند . عمومی ترین اندیکاسیون برای آمبولیزاسیون فیبروئید رحم وجود خونریزی های شدید یا غیر نرمال دوران قاعدگی می باشد .
بهتر شدن علائم در %۹۶_۸۰ از بیمارانی که آزمون UFE را با ذرات PVA انجام داده اند گزارش شده است . این رویه با کوچک شدن حجم رحم به میزان %۴۸_۴۰ و همچنین کاهش حجم فیبروئید به اندازه %۷۸_۴۶ همراه بوده است .
اخیراً گزارشهایی مبنی بر تداوم نتایج موفقیت آمیز حاصل از این آزمون بدست آمده است . گزارش شده است که در %۸۱ از بیماران که به مدت ۱۶ ماه تحت نظر بودند ، علائم آنها بعد از آزمون آمبولیزاسیون کاملاً بهبود یافته است . مشکلات ایجاد شده در بیمارانی که نیاز به درمان دیگر داشتند نادر بوده و تقریباً کمتر از %۲ می باشد .
Siskin ، Aziz و McLucas به طور جداگانه مطالعاتی را درباره اثرات بافت شناسی مشاهده شده بعد از آمبولیزاسیون شریانهای رحم با PVA انجام داده اند . Aziz و McLucas ، هر دو یادآوری کرده اند که این ذرات درون مجاری عروق را اشغال نمی کنند . در عوض ، واکنش جسم خارجی باعث اجتماع پلاکتها و شکل گیری ترومبوز در شبکه اینترالومینال ذرات PVA می شود . شکل گیری ترومبوز به انسداد شریانی منتج می شود و نهایتاً منجر به ادم interstitial (بینابینی) در داخل فیبروم می شود و به دنبال آن نکروز ایسکمیک اتفاق می افتد .
مایومتریوم مجاور با فیبروئید آمبولیزه شده با ذرات PVA زنده می باشد اما ادماتوز و به طور مزمن ملتهب می باشد .
Luminal recanalization ممکن است یکی از دلایل نقص درمان بعد از آمبولیزاسیون شریانهای رحم باشد ، چون ذرات PVA تمامی لومن عروق را اشغال نمی کنند و recanalization جزئی ترومبوز امکان پذیر است و گزارش شده است .
نارسایی درمان که در %۱۹-۴ از بیماران گزارش شده است ، ممکن است به فاکتورهای دیگری نسبت داده شود که شامل آمبولیزاسیون ناقص یک طرفه ، آدنومایوزیز ، فیبروئیدهای بزرگ ، باقی ماندن منبع تغذیه برای رحم و فیبروئید و سارکوماتوز است .
Aziz و همکارانش همچنین خاطر نشان کردند که بعد از آمبولیزاسیون شریان رحم ، ذرات PVA ممکن است در شریانهای قسمت parametrium و myometrium خارجی یافت شوند ، که این لایه ها ، عملکرد اندومتر را بعد از recanalization عروق بزرگ ، ادامه می دهند .
ولی آسیب رساندن غیر عمدی به اندامهای تحتانی ، که در این مورد رحم را شامل می شود ، می تواند منتج به ایسکمی رحم یا عفونت اندومتر شود که در هر دو این موارد برای درمان بایستی هیسترکتومی انجام شود .
فقط یک مورد عفونت منجر به sepsis و مرگ بعد از انجام UFE گزارش شده است . همچنین ممکن است بعد از آمبولیزاسیون ذرات در mesovarium و mesosalpinx یافت شوند که باعث اختلال در کارکرد تخمدانها و یا لوله های رحمی بر اثر کم شدن جریان خون به adnexa ( لوله های رحم و تخمدان ها ) می گردد .
آمنوری ( Amenorrhea ) دائمی ، اتفاق نادری است که در کمتر از %۲ بیماران ایجاد می شود و ممکن است بعد از آمبولیزاسیون شریانهای رحم با ذرات PVA اتفاق بیفتد و به نقصان کارکرد یا انفارکسیون تخمدانها نسبت داده می شود .
به هر حال ، با توجه به فقدان مدارک مبنی بر تغییر در سطح هورمون ( Follicle stimulating hormone ) FSH قبل و بعد از آمبولیزاسیون ، علت اصلی و ارتباط مؤثر بین آمبولیزاسیون با ذرات PVA و یائسگی زودرس تا این زمان ناشناخته باقی مانده است .
یکی دیگر از مشکلات نادر در UFE با ذرات PVA خارج شدن ترانس سرویکال فیبروئید آمبولیزه شده می باشد که باعث عفونت روده کوچک می شود و علت این عفونت ، فیبروئید پایک دار مجاور روده می باشد .
● ژل فوم ( Gel foam )
آمبولیزاسیون فیبروئید رحم ( UFE ) به عنوان یکی از روشهای موفقیت آمیز آمبولیزاسیون از طریق پوستی در عروق لگن می باشد . ولی برای بیشتر از دو دهه بود که آمبولیزاسیون به طور انتخابی یا به عنوان یک مورد اورژانس برای کنترال خونریزی های غیر طبیعی لگن به کار می رفت .
ژل فوم ماده هموستاتیک غیر محلول در آب بوده و از ژلاتین پوست تصفیه شده بدست می آید . ( یک کربوهیدرات غیر حساسیت زا nonantigenic ) و به طور مکرر به عنوان یک ماده آمبولیزه کننده درون عروقی biodegradable استفاده می شود .
Carrel و Wise اولین کسانی بودند که خاصیت هموستاتیک ژل فوم را معرفی کردند و استفاده آن را در هموستازیز بدست آمده در حین جراحی گزارش کردند. در این گزارش آمده است که ژل فوم هموستازیز را توسط رشد ترومبوز و مهیا کردن حمایت ساختاری برای ترومبوز ، تسریع می نماید .
در سال ۱۹۶۴ ، ژل فوم برای اولین بار به عنوان یک ماده درون عروقی برای انسداد فیستول کاروتید کاورنوس تروماتیک ( carotid cavernous fistula ) استفاده شد . از آن پس ژل فوم به طور موفقیت آمیزی در مقیاس خیلی وسیع به عنوان یک ماده آمبولیزه کننده در موارد متنوعی از قبیل رنال سل کارسینوما قبل از برداشتن آن توسط عمل جراحی ، سرطانهای استخوان ، خونریزی های دستگاه گوارش ، hemophilia و جراحات شریانی ناشی از تروما به کار می رود .
در سال ۱۹۷۹ ، Heaston و همکارانش برای اولین بار کاربرد ژل فوم را در لگن برای خونریزی های بعد از زایمان ، بعد از بستن ( Ligation ) دو طرفه شریان hypogastric تشریح کرده از آن پس خونریزی های بعد از زایمان ، خونریزی های بعد از عمل جراحی _ فیستولهای شریانی_وریدی ( AVF ) ، حاملگی های خارج از رحم ( Cervical ectopic pregnancies ) و خونریزی های حاصل از توده های بدخیم ناحیه لگن ، به طور خیلی مؤثری با آمبولیزاسیون رحم یا شریانهای ایلیاک داخلی توسط ژل فوم درمان می شوند .
در حال حاضر ، ژل فوم به دو صورت قابل دسترسی است . به صورت پودرهایی که ذرات محتوی آنها قطری در حدود &#۹۵۶;۶۰-۴۰ دارند یا به صورت ورقه ای که در سایزهای متفاوت قابل بریدن و استفاده می باشد .
ژل فوم نیز همانند PVA رادیوپاک نمی باشد ، از این رو قبل از تزریق با مواد حاجب ید دار مخلوط می گردد . ذرات کوچک در پودرهای ژل فوم باعث افزایش ریسک ایسکمی به علت انسدادهای قسمت انتهایی شریان می گردد .
لایه های بریده شده از ورقه ژل فوم معمولاً بزرگتر هستند و در نتیجه در انسدادهای قسمت پروگزیمال شریان به کار می روند . یک تکنیک تکمیلی برای بدست آوردن مخلوط ژل فوم بوسیله مخلوط کردن ورقه ها بین دو سرنگ از طریق شیر سه راهی ابداع شده است . در این روش ، اندازه ژل فوم تزریق شده کاهش داده می شود و ژل فوم به قسمت انتهایی تر می رسد .
از نظر بافت شناسی ، ژل فوم باعث نکروز کامل دیواره شریان می گردد زیرا باعث ایجاد تورم در منطقه می گردد و همچنین خاصیت الاستیکی عروق را مختل می کند .
حدود ۶ روز بعد از دریافت ژل فوم ، واکنش التهابی حاد ، واکنش جسم خارجی با حضور سلولهای بزرگ ( giant cells ) مشاهده می شود . این واکنشها به علت شکل گیری ترومبوز می باشد و ممکن است این علائم تا چندین ماه باقی بمانند .
ولی light و Prentice خاطر نشان کرده اند که واکنشهای سلولیتی ایجاد شده توسط ژل فوم تا روز سی ام فروکش می کند و در روز چهل و پنجم اثری از ترومبوز یا ژل فوم دیده نمی شود ، که این رویداد اساس فرضیه ای را تشکیل می دهد که می گوید :
ژل فوم باعث ایجاد انسدادهای کوتاه مدت با حداقل واکنش بافت می شود .
مطالعات نشان می دهد که زمان جذب مجدد ژل فوم در یک آمبولیزاسیون بین ۲۱-۷ روز می باشد . ولی وقتی که ژل فوم به عنوان هموستازیز ( منعقد کننده ) در جراحی ها استفاده می شد ، اسفنج های ژلاتینی غیر قابل جذب در زخم یافت شده اند که به مدت ۱۲-۲ ماه بعد از implantation در محل باقی می مانند .
انسدادهای شریانی که با ژل فوم ایجاد می شوند اغلب طی هفته ها یا ماه ها بعد از آمبولیزاسیون دوباره recanalization می شوند . در حیوانات زمان recanalization بعد از آمبولیزاسیون با ژل فوم از ۳ هفته تا ۴ ماه متغییر است .
Bracken و همکارانش روند recanalization شریانی را در دو بیمار که تحت آمبولیزاسیون رنال سل کارسینوما قرار گرفتند بعد از پنج و شش ماه مشاهده نمودند. به هر حال انسداد دائمی بعد از آمبولیزاسیون با ژل فوم مشاهده شده است . Junder و Russinovich یافتند که انسدادهای دائمی که توسط ژل فوم ایجاد می شود ، ممکن است به مقدار و میزان ژل فوم مصرف شده بستگی داشته باشد و بیان می کنند که اگر در خونریزی های عروق مقدار زیادی ژل فوم استفاده شود ، انسداد دائمی خواهد بود .
ایسکمی و عفونت مشکلاتی هستند که در استفاده از ژل فوم به عنوان ماده آمبولیزه کننده مطرح می باشد . وقتی که ژل فوم در لگن استفاده می شود مشکلات ایسکمی شامل :
▪ ایسکمی باسن
▪ فلج اندامهای تحتانی
▪ گانگرن مثانه می باشد .
این مشکلات به اندازه کوچک مواد آمبولیزه کننده نسبت داده می شود ، به همین دلیل توصیه می شود پودر ژل فوم در موارد غیر بدخیمی ( nonmalignant ) استفاده نشود .
مشکلات عفونی شامل سه مورد آبسه لگن بعد از آمبولیزاسیون لگن با ژل فوم گزارش شده است . به علاوه ، عفونتهای کبدی در نتیجه بوجود آمدن آبسه ها گزارش شده است وقتی که از ژل فوم در کموآمبولیزاسیون شریان هپاتیک استفاده شده بود. این عفونتها ممکن است به طور بالقوه در استفاده از ژل فوم مطرح باشند زیرا ژل فوم مقداری حباب هوا که برای فعالیتهای میکروبهای هوازی ( aerobic organisms ) مناسبند در اندام نگه می دارد . بدلیل این احتمال ، توصیه می شود تا جایی که امکان دارد از ژل فوم در جراحی ها استفاده شود و از قرار گرفتن طولانی ژل فوم در معرض هوای آلوده اجتناب شود . کمپرس کردن آن صورت گیرد تا حبابهای هوای درون آن به حداقل برسد و به درون بدن بیمار راه نیابد .
●نقش ژل فوم در UFE
زمانی که یک بیمار در سن باروری کاندید عمل UFE می شود ، این سؤال که آیا قدرت باروری وی محفوظ می ماند ، بر کل پروسه تقدم پیدا می کند . با مرور مجدد نتایج پروسه آمبولیزاسیون لگن ممکن است راهنمایی هایی برای اندیکاسیون های متفاوت بدست آید و مشخص شود که آیا آمبولیزاسیون اثری برروی قدرت باروری بیمار در کل دوران سن باروری وی دارد ؟
Stancato_pasik و همکارانش ۱۲ بیمار را بررسی کردند که تحت عمل آمبولیزاسیون با ژل فوم بدلیل خونریزی بعد از زایمان قرار گرفته اند . ۱۱ نفر از آنها ، قاعدگی های نرمال داشتند و همه بیمارانی که تمایل به بچه دار شدن داشتند ( ۳ نفر از ۱۲ نفر ) نوزادان سالم به دنیا آوردند .
McIvor و Cameron گزارش داده اند که از ۷ بیماری که عمل آمبولیزاسیون برای کنترل خونریزی عمل بعد از زایمان داشته اند ، ۶ نفر حاملگی موفقی داشتند . چندین گزارش دیگر در مورد حاملگی های موفق بعد از آمبولیزاسیون با ژل فوم برای کنترل خونریزی های بعد از جراحی ، حاملگی های خارج از رحم و دیگر اندیکاسیون ها موجود می باشد .
تمام این یافته ها نشان می دهد که آمبولیزاسیون با ژل فوم برای کنترل خونریزی های غیر طبیعی رحم مؤثر است و در عین حال می تواند توانایی بیمار را در داشتن قاعدگی و حاملگی حفظ کند .
اما هنوز شواهد مطمئنی مبنی بر حفظ قدرت باروری و قاعدگی بعد از عمل UFE با ذرات PVA در دست نیست . تا کنون حداقل ۱۴ مورد حاملگی در ۱۰۰۷ بیماری که تحت عمل UFE با ذرات PVA قرار گرفته اند گزارش شده است .
این شواهد نشان می دهد که آمبولیزاسیون شریانهای رحم با PVA باعث از بین رفتن کامل امکان حاملگی در آینده نمی شود .
مشکل اینجاست که تعداد واقعی بیمارانی که قصد دارند بعد از عمل UFE بچه دار شوند در مقایسه با بیمارانی که کاندید انجام این عمل هستند بسیار کم است . بیمارانی که تحت درمان فیبروئید رحم علامت دار قرار می گیرند ، معمولاً در حدود سن یائسگی هستند و اشتیاقی برای بچه دار شدن ندارند . بدلیل این واقعیت ها و بی میلی خیل از مراکز در انجام دادن این عمل برای کسانی که می خواهند در آینده بچه دار شوند ، احتمال حاملگی بعد از UFE با ذرات PVA نا مشخص می باشد .
اخیراً میل به کاربرد ژل فوم به عنوان یک ماده آمبولیزه کننده در UFE افزایش یافته است ، زیرا ثابت شده است که با کاربرد این ماده در انسداد عروق لگنی قدرت باروری بیمار حفظ می گردد . امروزه نتایج اولیه از دو مطالعه برروی کاربرد ژل فوم در UFE در یک نشست ملی ارائه شده است . Katz و همکارانش نتایجی از مطالعه برروی ۱۰ بیماری که تحت عمل UFE قرار گرفته اند ارائه داده است ؛ ۵ بیمار PVA و ۵ بیمار ژل فوم دریافت نمودند . این مطالعه نتایج یکسانی را در هر دو گروه از نظر برطرف شدن علائم و کاهش حجم رحم و فیبروئید نشان می دهد . Mizukami و همکارانش در ۱۸ بیمار ژل فوم استفاده کرد و گزارش داد %۸۹ بهبود علائم و به طور متوسط %۴۵ کاهش در حجم رحم مشاهده شده است . در حقیقت این نتایج اولیه در گروه کوچکی از بیماران بدست آمده است . مطالعات وسیع تر باید با یک پیگیری قاطع از نظر تاثیرات کلینیکی ژل فوم در UFE انجام شود .
به علاوه ، حتی با در نظر گرفتن اطلاعات کلینیکی که استفاده از ژل فوم را تأیید می کنند ، مطالعات پاتولوژیک که نشان دهنده توانایی ژل فوم در از بین بردن فیبروئید ( هدف اصلی این آزمون ) هستند ، قبل از اینکه استفاده از ژل فوم عمومی شود باید مد نظر قرار گیرند . و در آخر اینکه ، قبل از اینکه برای بیمارانی که مایلند توانایی باروری خود را بعد از UFE حفظ کنند ، ژل فوم را به عنوان یک ماده آمبولیزه کننده پیشنهاد کنند ، باید امکان حاملگی بعد از آمبولیزاسیون شریان رحم با ژل فوم مشخص شود و گزارش گردد .
● نتیجه گیری
امروزه مشکلات بالقوه و شناخته شده UFE همیشه به مراحل بیماری نسبت داده می شود که بوسیله این تکنیک یا خود تکنیک شروع می شود ، همراه با مشکلات نادر که به طور مستقیم به ذرات PVA نسبت داده می شود . با توجه به این واقعیتها و موفقیتهای بالینی ذرات PVA ، این ماده به عنوان ماده آمبولیزه کننده انتخابی در UFE باقی می ماند ، تا زمانی که یک ماده کاملاً اختصاصی و خیلی مؤثر برای این پروسه بدست آید .
با افزایش درخواست این پروسه برای بیماران جوانتر که خواهان حفظ توانایی بچه دار شدن خود هستند ، مطالعات آینده باید با قاطعیت احتمال حاملگی بعد از آمبولیزاسیون را مشخص کند .
در حال حاضر ، حاملگی بعد از UFE با PVA نشان می دهد که این توانایی بعد از عمل UFE حفظ می شود . به هر حال اگر بتوان اثرات کلینیکی و قدرت باروری بعد از استفاده از ژل فوم در UFE را حفظ کرد ، این ماده می تواند به عنوان یک انتخاب خوب در بیمارانی که می خواهند در آینده بچه دار شوند و قدرت باروری رحم آمبولیزه شده را حفظ کنند ، برگزیده شود .
Embolic Agents used for uterine Fibroid Embolization
Gary P.Siskin , AJR : ۱۷۵ , sep ۲۰۰۰ pages ۷۶۷_۷۷۳
http://www.ajronline.org/
Gary P.Siskin , AJR : ۱۷۵ , sep ۲۰۰۰ pages ۷۶۷_۷۷۳
http://www.ajronline.org/
منبع : جامع علوم رادیولوژی ایران
همچنین مشاهده کنید
نمایندگی زیمنس ایران فروش PLC S71200/300/400/1500 | درایو …
دریافت خدمات پرستاری در منزل
pameranian.com
پیچ و مهره پارس سهند
خرید میز و صندلی اداری
خرید بلیط هواپیما
گیت کنترل تردد
ایران حجاب رئیس جمهور رئیسی دولت سیزدهم دولت توماج صالحی سریلانکا سیدابراهیم رئیسی پاکستان کارگران مجلس شورای اسلامی
کنکور تهران سیل آتش سوزی هواشناسی سازمان سنجش پلیس زنان سلامت شهرداری تهران اصفهان فراجا
قیمت خودرو خودرو قیمت طلا دلار بازار خودرو مسکن قیمت دلار ارز بانک مرکزی ایران خودرو تورم قیمت
موسیقی رهبر انقلاب خانواده فیلم تلویزیون ترانه علیدوستی سینمای ایران مهران مدیری بازیگر تئاتر
کنکور ۱۴۰۳ عبدالرسول پورعباس
غزه آمریکا اسرائیل رژیم صهیونیستی جنگ غزه فلسطین روسیه حماس اوکراین طوفان الاقصی ایالات متحده آمریکا ترکیه
پرسپولیس فوتبال استقلال بازی جام حذفی سردار آزمون بارسلونا لیگ برتر انگلیس باشگاه استقلال باشگاه پرسپولیس فوتسال تراکتور
هوش مصنوعی ناسا رونمایی بنیاد ملی نخبگان گوگل تیک تاک فیلترینگ
دندانپزشکی مالاریا کاهش وزن زوال عقل سلامت روان داروخانه