سه شنبه, ۱۴ اسفند, ۱۴۰۳ / 4 March, 2025
بمب های هوشمند
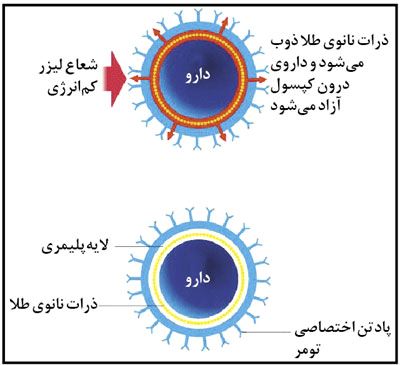
كپسول های پلیمری در مقیاس نانو، روزی می توانند جهت انتقال مستقیم شیمی درمانی به تومورها بدون آسیب به بافت های مجاور مورد استفاده قرار گیرند، كپسول ها طوری طراحی می شوند كه وقتی یك پالس لیزر با انرژی كم را دریافت می كنند، باز شده و محتویات خود را دقیقاً در جایی كه مورد نیاز است آزاد می كنند.
اگر داروهای ضدسرطان به سوی هدفشان یعنی یك تومور، هدایت شده و محتویات خود را در یك انفجار منفرد آزاد كنند، می توانند بیشتر موثر بوده و اثرات جانبی كمتری داشته باشند. این حالت به دارو اجازه می دهد در عین به حداقل رساندن آسیب به بافت های اطراف به غلظت مورد نیاز جهت از بین بردن سلول های سرطانی دست یابند.
فرانك كارسو و گروهش در دانشگاه ملبورن استرالیا در حال ایجاد یك راه مبتكرانه برای انجام این كارهستند. راهكار آنها، محصور كردن دارو در كپسولی پلیمری است كه با ذرات بسیار ریز طلا بمباران شده و به آنتی بادی های شناسایی كننده تومور متصل شده است.زمانی كه كپسول وارد جریان خون می شود، كپسول ها داخل تومورها جمع می شوند و وقتی به میزان لازم كپسول ها در آن جمع شدند، یك پالس از یك لیزر نزدیك مادون قرمز، ذرات طلا را كه به میزان زیادی طول موج های مادون قرمز را جذب می كند ذوب كرده و این امر باعث باز شدن كپسول پلاستیكی و سپس آزاد شدن محتویات آن می شود.
●لیزر نزدیك مادون قرمز
برای ساختن كپسول ها، محققان مكرراً پلیمر را به سوسپانسیون ذرات دارو با عرض یك میكرومتر اضافه می كنند تا زمانی كه اجسام كروی واجد داروی قابل انتقال شكل بگیرند. آنها سپس ذرات طلا با ضخامت ۶ نانومتر را به مخلوط اضافه می كنند كه این ذرات پلیمر را احاطه كرده و در آن فرو می روند. سرانجام آنها یك چربی كه لایه خارجی كپسول را شكل می دهد و آنتی بادی هایی كه سلول های توموری را مورد هدف قرار می دهد، اضافه می كنند.
در بررسی های آزمایشگاهی كپسول ها به وسیله یك پالس ۱۰ نانو ثانیه ای از یك لیزر نزدیك مادون قرمز باز می شوند. در حالی كه طلا نقطه ذوب ۱۰۶۴ درجه سانتی گراد دارد، ذرات طلا در دماهای بسیار پایین تر ذوب می شوند. یك پالس كوتاه با حرارت بین ۶۰۰ تا ۸۰۰ درجه سانتی گراد برای ذوب كردن ذرات بسیار ریز كافی است، ذراتی كه این حالت زیر میكروسكوپ الكترونی مشاهده شود قطرشان تا بیشتر از ۵۰ نانومتر به علت یكی شدن شان افزایش یافته است.
●محدودیت های ایمنی
در استفاده بالینی، لیزر قادر به نفوذ به میلی مترهای بافت هاست. این حالت می تواند از طریق پوست یا پرتوافكنی داخل بدن از طریق یك آندوسكوپ نشان داده شود. ۱۰۰ میلی ژول انرژی مادون قرمز در هر سانتی متر مربع جهت باز كردن در محدوده ایمنی، مورد نیاز است. كارسو می گوید این میزان كمتر از مقدار مورد استفاده در حذف خال كوبی هاست، البته هنوز جهت استفاده بالینی از این روش باید منتظر ماند، و حتی تا استفاده حیوانی چندین سال زمان لازم است.
پیشرفت و اصلاح بعدی ساختن كپسول های بسیار كوچك تر خواهد بود. طرح های كارسو كوچك كردن آنها از حدود یك میكرومتر قطر به یك جفت ۱۰۰ نانومتری به وسیله شروع كردن با ذرات دارویی كوچكتر است. كارسو فكر می كند نوآوری كلیدی گروه او ساختن كپسول هایی است كه برای بدن بی خطر باشد.
طلا معمولاً نور را از بخش مرئی طیف الكترومغناطیس كه می تواند بافت ها را بسوزاند جذب می كند، اما واكنش های الكترومغناطیسی میان ذرات بسیار ریز طلا در كپسول ها ویژگی فلز را تغییر داده و باعث می شود كه آنها نور را به جای ناحیه مرئی از ناحیه نزدیك طیف مادون قرمز جذب كنند كه این نور، بیشترین نور گذر كننده از بافت هاست.
New Scientist، ۷Jan، ۲۰۰۶

ایران مسعود پزشکیان دولت چهاردهم پزشکیان مجلس شورای اسلامی محمدرضا عارف دولت مجلس کابینه دولت چهاردهم اسماعیل هنیه کابینه پزشکیان محمدجواد ظریف
پیاده روی اربعین تهران عراق پلیس تصادف هواشناسی شهرداری تهران سرقت بازنشستگان قتل آموزش و پرورش دستگیری
ایران خودرو خودرو وام قیمت طلا قیمت دلار قیمت خودرو بانک مرکزی برق بازار خودرو بورس بازار سرمایه قیمت سکه
میراث فرهنگی میدان آزادی سینما رهبر انقلاب بیتا فرهی وزارت فرهنگ و ارشاد اسلامی سینمای ایران تلویزیون کتاب تئاتر موسیقی
وزارت علوم تحقیقات و فناوری آزمون
رژیم صهیونیستی غزه روسیه حماس آمریکا فلسطین جنگ غزه اوکراین حزب الله لبنان دونالد ترامپ طوفان الاقصی ترکیه
پرسپولیس فوتبال ذوب آهن لیگ برتر استقلال لیگ برتر ایران المپیک المپیک 2024 پاریس رئال مادرید لیگ برتر فوتبال ایران مهدی تاج باشگاه پرسپولیس
هوش مصنوعی فناوری سامسونگ ایلان ماسک گوگل تلگرام گوشی ستار هاشمی مریخ روزنامه
فشار خون آلزایمر رژیم غذایی مغز دیابت چاقی افسردگی سلامت پوست