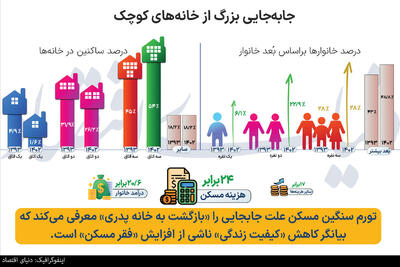
پنجشنبه, ۲۷ دی, ۱۴۰۳ / 16 January, 2025
آنزیم های منعقدکننده شیر

اساس انعقاد آنزیمی شیر به حساسیت کاپا کازئین و حضور یون کلسیم بستگی دارد .پس از شکسته شدن کاپا کازئین در حضور آنزیم و به هم ریختن ساختار آن میسل ها تجمع کرده ودر هم فرو می روند و تشکیل دلمه می دهند و انعقاد رخ می دهد. واژه های کلیدی : انعقاد آنزیمی شیر٬ آنزیم های میکروبی٬ رنت ٬کازئین
● مقدمه و اهمیت موضوع
انعقاد شیر عبارت از تجمع میسلهای آن به صورت یک شبکه است.این شبکه نمایانگر فاز جامد می باشد
وگلبولهای چربی در آن محصور می شوند .شیر در روشهای متداول پنیر سازی٬ با افزودن آنزیم های ویژه ای دلمه می شود.
ماده پروتئینی عمده شیر موسوم به کازئینوژن به صورت لخته تشکیل می گردد . انعقاد شیر به صورت پنیر به وسیله ی عمل اسید حاصل از تخمیر لاکتوز به واسطه ی باکتری ها یا به وسیله ی مایه پنیر به دست آمده از معده چهارم نشخوارکنندگان شیر خوار و یا هر دو توأم با یکدیگر صورت می گیرد . اثر منعقد کننده ی پنیر مایه مربوط به آنزیم رنین است که پروتئین شیر را منعقد می کند و آن را به صورت لخته می سازد . در غالب موارد با این که برای انعقاد شیر مایه پنیر به کار می برند ، مقداری باکتری نیز به منظور تولید اسید و کمک به تشکیل لخته ی پنیر اضافه می کنند ، به علاوه از باکتری های تولید کننده بوی خوش و یا باکتری های تولید کننده گاز نیز استفاده می شود .(۵)
پروتئازها نسبت به آنزیم های دیگر برای کنترل انعقاد شیر ترجیح داده می شوند. پروتئازهای موجود در پنیر مایه که در انعقاد شیر دخیل می باشند وباعث تشکیل لخته در پنیر سازی می شوند
شامل:کیموزین٬پپسین وپروتئازهای میکروبی بوده وعموما برای تولید پنیرهای مختلف کاربرد دارند.(۳)
میزان کیموزین تحت تاثیر تغذیه دام قرار می گیرد.میزان کیموزین از عصاره استخراج شده ۷۵ تا ۱۰۰ درصد متغیر می باشد وهمچنین میزان پپسین از عصاره استخراج شده حداقل ۳۰ درصد می باشد لذا رنت شامل دو ترکیب کیموزین وپپسین می باشدکه در گوساله تازه متولد شده (calf) نسبت کیموزین به پپسین ۹۵ درصد به۵درصد می باشد .(۴)
۲-آنزیم های منعقد کننده شیر:(۱)٬(۲)
۲-۱-آنزیم های حیوانی مانند: رنین٬کیموزین٬پپسین٬تریپسین٬کیموتریپسین
۲-۲-آنزیم های گیاهی مانند: پاپائین٬فیسین٬بروملین
۲-۳-آنزیم های میکروبی مانند: باکتریها و قارچهای سنتز کننده آنزیم
۲-۴-پروتئازهای طبیعی شیر ( قلیایی یا پلاسمی اسیدی )
۲-۱-آنزیم های حیوانی:
۲-۱-۱-رنین (Rennin) :(۲)
شکل خالص آنزیم موجود در رنت (Rennet) یا مایه پنیر است که در پنیر سازی از آن استفاده می شود همانطور که اشاره شد این آنزیم از معده چهارم گوساله شیر خوار استخراج می گردد.پس از اینکه گوساله شروع به مصرف علف می کند به جای رنین پپسین ترشح می شود.
در روش سنتی شیردان یا معده چهارم گوساله جوان را خشک کرده ونمک می زنند وسپس آن را به ذرات کوچک بریده وعصاره آنزیمی را به وسیله محلول نمک ۱۰درصد استخراج کرده وسپس با اضافه کردن اسید٬PH آن را تنظیم کرده و سپس با افزودن نمک(۱۶-۲۰درصد)ومواد نگهدارنده٬رنین را صاف می کنند.اغلب کارامل برای استاندارد کردن رنگ وگهگاهی نیز مواد طعم دهنده برای پوشش بوهای تند حاصل از معده استفاده می شود. این آنزیم به صورت پودرهای هیدراته٬گرانول و یا مایع عرضه می شود.
مکانیزم عمل رنین:(۲)
این آنزیم به حالت غیر فعال به نام پرورنین(Prorennin) ترشح می گردد.ماده استخراج شده از معده خشک شده ٬ هم دارای رنین وهم دارای پرو رنین می باشد.تبدیل پرورنین به رنین با افزودن اسید تسریع می گردد.این فرایند به صورت اتوکاتالیتیک است٬یعنی با تولید مقداری رنین ٬این ماد ه بقیه پرورنین را به رنین فعال تبدیل می کند.پپسین نیز می تواند کار تبدیل پرورنین به رنین را انجام دهد.عمل تبدیل پرورنین به رنین همراه با آزاد شدن پپتیدهایی از قسمت انتهای N ملکول پرورنین می باشد که طی آن وزن مولکولی از ۳۶۰۰۰ به ۳۱۰۰۰ کاهش می یابد.
سه پیوند دی سولفید قسمتهای مختلف پرورنین را به هم متصل می کنند که بعد از تبدیل به رنین نیز بدون تغییر باقی می مانند.PH مناسب برای فعالیت رنین ۳.۵ است اما بیشترین پایداری آن در PH =۵ مشاهده میشود.
۲-۱-۲- کیموزین:
حساسیت به هیدرولیز در حضور آنزیم کیموزین یا لخته دادن به وسیله کلسیم از جمله خواص کازئین به شمار می رود.کیموزین به باند پپتیدی بین فنیل آلانین ۱۰۵ ومتیونین ۱۰۶ واقع در کاپا کازئین به سرعت حمله ور شده ٬ آن راهیدرولیز می کند در نتیجه کاپا کازئین قدرت تثبیت کنندگی خود را در قبال ممانعت ازرسوب میسلهای کازئین از دست داده ٬ میسلها در حضور کلسیم متراکم می شوند .(۳)
کیموزین از منابع میکروبی نیز به دست می آید.
کیموزین استحصالی از اشرشیاکلای در سال ۱۹۹۰ میلادی در آمریکا مهمترین نوع مایه پنیر محسوب می شده است.همچنین کیموزین استحصالی ازKluyeromyces lactic دربعضی از کشور های اروپایی نظیر آلمان ٬دانمارک ٬پرتقال برای پنیرسازی استفاده می شود.(۱)
۲-۱-۳-پپسین:(۲)
این آنزیم به صورت غیر فعال موسوم به پپسینوژن در مخاط پوششی سطح معده تولید می گردد که در PH پایین معده با جداشدن پپتید های کوچک از قسمت انتهای Nمولکول به پپسین فعال تبدیل می گردد.پپسین از۳۲۱ اسید آمینه تشکیل شده است .پپسین در PH بیشتر از ۵ دناتوره می شود وفعالیت خود را از دست می دهد.این آنزیم ترجیها اتصالات مجاور فنیل آلانین٬تیروزین وتریپتوفان را می شکند.این پروتئاز که در PH پایین واسیدی عمل می کند در تولید پنیر استفاده می شود اما کیفیت پنیر تولیدی به خوبی پنیر تولید شده توسط رنین نیست چراکه امکان تولید پپتید های تلخ مزه وجود دارد.
تلخی حاصله را می توان با به کار گیری کربن فعال٬آنزیم کربوکسی پپتیداز A ویا اولترافیلتراسیون کاهش داد ویا حذف نمود .
پپسین طیور:
پپسین طیور می تواند پروتئین شیر را در PH اسیذی منعقد نماید. چنانچه میزان کشتار طیور در کشتارگاه ها خیلی زیاد باشد جایگزینی پپسین طیور به جای مایه پنیر رنین مقرون به صرفه است.
۲-۱-۴-ترپسین وکیمو تریپسین :(۲)
این دو آنزیم از پانکراس در روده ترشح می شوند .تریپسین پیوند پپتیدی تشکیل شده توسط گروه کربوکسیل اسید آمینه لیزین یا آرژنین با سایر اسیدهای آمینه را می شکند . کیمو تریپسین در واقع شامل چندین نوع آنزیم شبیه به هم است که با پیشوند آلفا٬بتا٬گاما٬دلتا وپی مشخص می شوند.اینها پیوند مجاور اسید های آمینه تیروزین ٬فنیل آلانین و تریپتوفان را می شکنند وPH مناسب برای فعالیت آنها حدود۸ است.
۲-۲-آنزیم های گیاهی:
این آنزیمها دارای ریشه گیاهی هستند.محل فعال این آنزیمها دارای یک سیستئین ویک هیستیدین است که برای فعالیت آنها ضروری می باشد.(۲)
به عنوان مثال پرتئازهای گیاهی به کار گرفته شده برای تولید پنیر در نواحی مختلف جهان شامل پاپائین ٬بروملین ٬فیسین٬اوریزاسین (Oryzasin) از گیاه (Oriza sativa)٬کاکامیسین (Cucumisin) از (Cucumis melo ssp) ٬پروتئازسیب فاسد شده از(Calotropis) وپروتئازکاهو از(Lactuca sativa) استحصال می شود. (۸) دانه گیاه علفی Solanum dubium fresen که بومی سودان است٬ توانایی انعقاد شیر رابه خاطر حضور پروتئاز های سرینی پایدار دارد.(۷)
۲-۲-۱-فیسین:
فیسین (Ficin) از شیره سفیدرنگ یا لاتکس درخت انجیر(Ficus Carica) تهیه می شو. فیسین می تواند پروتئین های شیر رادر PH۷ الی ۸ کواگوله نماید.(۱)
۲-۲-۲-پاپائین:
پاپائین (Papain)که از خربزه درختی (Carica Papaya) که ٬کاملا رسیده نباشد ٬به دست می آید . این آنزیم در PH ۷-۴ ودرجه حرارت ۷۰-۴۰ درجه سانتیگراد فعال می باشد.(۱)
۲-۲-۳-بروملین:
بروملین (Bromelain) که از آناناس (Ananas Comosus) استحصال می شود . قدرت انعقادی این مایه پنیر در مقایسه با فیسین و پاپائین بسیار ناچیز است. (۱)
۲-۲-۴-معایب آنزیم های گیاهی منعقد کننده شیر:(۱)
_ در پنیر تولید شده توسط این نوع از آنزیم ها طعم ومزه تلخ ایجاد می شود.
(آمونیاک)NH۳→ اسید آمینه→ مایه پنیر گیاهی → پپتید در شیر
_ راندمان تولید پنیر در مقایسه با مایه پنیر حیوانی کاهش می یابد.
_ کیفیت پنیر تولید شده از لحاظ ارگانولپتیکی کاهش می یابد.
۲-۳-آنزیم های میکروبی:
مایه پنیر های میکروبی (microbial rennet) پس از جنگ جها نی دوم مصرف آن در پنیر سازی به سرعت افزایش یافته که از قارچ های Mucor Miehei وMucor Pusilus و Endothia parasitica استخراج وبه صورت تجارتی عرضه می شوند.(۴)٬ (۳)
آنزیم های میکروبی انعقاد شیر به طور مطلوب جایگزین مایه پنیر های حیوانی در صنعت پنیر سازی شده اند. آسپرژیلوس اوریزه (Aspergillus oryzae) ازبین ۱۶ نژاد قارچ برای تولید بیشترین فعالیت انعقادی شیر٬ انتخاب شده است .(۹)
از باکتری های تولید کننده آنزیم های منعقد کننده شیر می توان به استرپتوکوکسیهای مزوفیل٬نظیر استرپتوکوکوس لاکتیس واسترپتوکوکوس کرموریس اشاره کرد .اما به دلیل خاصیت پروتئولیتیکی نسبتا پایین اینها ٬توصیه می شود ازاسترپتوکوکوس فکالیس واسترپتوکوکوس دورانس استفاده شود.همچنین از محیط کشتهای ویژه ای بدین منظور استفاده میشود مثلا فعالیت قابل توجه آنزیم حاصل از باسیلوس سوبتیلیس زمانی فراهم میشود که باکتری در محیط کشتی با پایه نمکی در PH=۶ ودرجه حرارت ۳۷ درجه سانتی گراد با شیک کردن rpm ۱۷۵ در طی یک روز ٬ کشت داده شود .(۹)
این باکتری ها در مقایسه با استرپتوکوکسی های لاکتیس و کرموریس ٬ از حداکثر دمای رشد بالاتری برخوردارمی باشند (بیش از ۴۵ درجه سانتیگراد).(۳)
از آنجایی که کپکها ٬ خصوصا سویه های پنی سیلیوم در تولید پنیر آبی و انواعی که کپکها در سطح آنها رشد می کنند به کار می روند ٬ این سئوال مطرح می گردد که آیا در این پنیر ها مایکو توکسین تولید می شود یا نه؟
۱. غلظت ۰.۰۵تا ۶ppm آلکالوئید راکوفورتین در پنیر آبی آ برای ایجاد مسمومیت ٬ بسیار پایین می باشد.
۲.توکسین توسط تعداد اندکی از سویه های پنی سیلیوم راکوفورتی وآن هم در محیط کشت های مصنوعی تشکیل می شود . بنابراین ٬ ترکیب فوق٬ به هیچ وجه در پنیر یافت نمی شود .
۳. توکسین (پاتولین ) که ماده ای سرطان زا در موشهاست ٬توسط آن دسته از سویه های پنی سیلیوم راکوفورتی که در پنیر سازی به کار برده می شوند ٬تولید نمی گردد.
۲-۴- پروتئازهای طبیعی شیر:
آنزیم های طبیعی یا به طور طبیعی در شیر خام وجود دارندیا از برخی از باکتری های سرمادوست که به میزان زیادی پروتئینازهای فعال تولید می کنند ناشی می شود . Auclair و Lenoir در سال ۱۹۸۰ خاطر نشان کردند که سرد مردن شیر خام سبب انتقال پروتئیناز قلیایی ( پلاسمین) از فاز کلوئیدی به فاز سرمی می شود. بتا کازئین در دمای پایین ممکن است به دو جزء گاما کازئین و پروتئوزپپتون هیدرولیز شود این دو بعد ها در حضور پروتئینازهای دیگر به پپتیدهای تلخ تبدیل شده مزه ای تلخ به شیر می دهند در نتیجه راندمان پنیر در اثر این تبدیل پایین می آید .(۳)
۳-مکانیزم انعقاد به وسیله مایه پنیر:
۳-۱-کازئین:
کازئین شیر حدود۷۵تا۸۵ درصد پروتئین شیر را کازئین تشکیل می دهد .معمولا کازئین به صورت خالص درشیر موجود نیست بلکه ابتدا به صورت کازئینات کلسیم است وسپس با جذب فسفات کلسیم فسفوکازئینات کلسیم تشکیل می شود که شبیه دانه های تمشک است در پروتئین کازئین حدود ۲۰ اسید آمینه شرکت دارند .اندازه کازئین حدود ۲۰-۱۰ میلی میکرون است وحرارت های پایین اصولا تاثیری روی کازئین ندارد حرارت از ۱۳۰ درجه سلسیوس بالاتر روی کازئین اثر می گذارد وممکن است تغییراتی در بافت پروتئینی کازئین به وجود آورد کازئین به ۴قسمت تقسیم می شود( آلفا۱،آلفا۲)،بتا،کاپاوگاماکه به نسبت های متفاوتی در کازئین شیر وجود دارندکاپا کازئین را فاکتورپایدارکننده(STABILIZING FACTOR)گویند ،زیرا موجب می شود میسل ها در شیر به صورت معلق درآیند ورسوب نکنند ،اگر کاپا کازئین راجداکنند حالت پایدار از بین می رود وپروتئین کازئین در کنار یون کلسیم رسوب می کندماده ای به نام رنین می تواند کاپا کازئین را از شیر بیرون بکشد ،اگر یون کلسیم در شیر نباشد حتی اگر کاپا کازئین بیرون کشیده شود رسوب نمی کند. ۱۰-۷درصد رنین داخل شیر می ریزند وتا دمای ۵۰-۴۲ درجه سلسیوس حرارت میدهند شیر رسوب میکند (لخته رنینی تشکیل می شود) ،انعقاد شیر توسط اسیدهم انجام می شود PHشیر ۶/۶-۴/۶ است لخته ای که توسط اسید به وجود می آید اسید کازئین ولخته ای که توسط رنین به وجود می آید رنین -کازئین است لخته رنین-کازئین بهتر است چون کلسیم وفسفر بالا تری نسبت به لخته اسید-کازئین دارد بهترین اسید برای ایجاد لخته ،لاکتیک اسید است)درمورد رنین برای ایجاد لخته حتما یون کلسیم را نیاز داریم ولی در مورد اسید یون کلسیم را نیاز نداریم (از آبلیمو ،سرکه و.......)نیز می توان استفاده پس از جداشدن کازئین آنچه می ماند آب پنیر است (whey protein)این مایع که پس از رسوب دادن کازئین وصاف کردن آن به دست می آید حاوی گلوبولین ها ،لاکتوفرینها ،سرولوآلبومین ،ایمیونوگلوبینها ،پروتئوپپتوفرکشن ولاکتو فرین می باشد لاکتوفرین از پروتئینهای آهن دار است پروتئینهای بالا برخلاف کازئین به حرارت حساسند واگر دمااز۶۰درجه سلسیوس بالاتر رود رسوب می کنند ولی در مقابل اسید و رنین مقاومند. (۶و۳)
۳-۲-انعقاد شیر توسط مایه پنیر در دو مرحله انجام می شود:
در مرحله اول که آنزیمی است آنزیم روی کاپا- کازئین که دارای ۱۶۹ اسید آمینه می باشد اثر می کند و پیوند میان فنیل آلانین و متیونین را که به ترتیب اسیدهای آمینه شماره ۱۰۵ و ۱۰۶ در این پروتئین هستند می شکند در نتیجه کاپا- کازئین به دو بخش کازئینو- ماکروپپتید محلول وپارا کاپا کازئین نامحلول شکسته می شود .به دنبال این اثر حفاظت کننده کاپا کازیین روی s ۹۴۵;- کازئین ازبین می رود.
این واکنش آنزیمی حتی ممکن است در درجه حرارت ۵درجه سانتیگراد نیز اتفاق افتد.
در مرحله دوم که غیر آنزیمی است٬کازئین تغییر یافته تحت اثر یون کلسیم رسوب میکند.سایر آنزیمهای تجزیه کننده پروتئین٬نظیر پپسین و پروتئازهای میکروبی نیز می توانند همان پیوند ذکر شده را بشکنند.)۴)٬(۲)
انعقاد شیر با افزودن آنزیم های منعقد کننده٬ تنها در حضور یون کلسیم عملی می گردد.(۳)
۵-نتیجه گیری:
٭تفاوت کلی بین آنزیم های حیوانی و گیاهی منعقد کننده شیر اینست که مایه پنیر های حیوانی حاوی ۸- ۴ درصد پروتئازهای فعال وناخالصی هایی نظیر ماده لزج و نمک می باشد.اما مایه پنیر های میکروبی حاوی ۸۰- ۹۰ درصد پروتئازفعال است.(۱)
٭عصاره های گیاهی در مقادیر زیاد سبب پروتئولیز شدید وایجاد طعم تلخ می شوند ولی مقادیر پایین آن محصولی با کیفیت بالا می دهد .
٭ منعقده کنندهای گیاهی در مقایسه با کیموزین زمان تشکیل ژل کوتاهتری دارند.(۱۰)
* فعالیت ضعیف پروتئیناز در شیر پاستوریزه یا پنیر عملا هیچ اهمیتی ندارد ٬ با این وجود نگهداری شیرUHT به مدت طولانی در دمای اتاق منجر به آن می شود که آنزیم فوق محصول را لخته و طعم تلخی به آن می دهد.(۳)
مهدی یوسفیان
فهرست منابع:
۱.ضیابری م.۱۳۸۳.تکنولوژی شیر وفرآورده های آن.نشر علوم کشاورزی.چاپ پنجم.
۲.فاطمی ح.۱۳۸۷.شیمی مواد غذایی.شرکت سهامی انتشار.چاپ هفتم(۲۷۶-۲۷۵)
۳.مرتضوی ع.قدس روحانی م.جوینده ح.۱۳۸۰.تکنولوژی شیروفرآورده های لبنی.انتشارات دانشگاه فردوسی مشهد.چاپ پنجم .(ش ص ۶۰)و (ش ص ۳۶-۳۳)و (ش ص ۱۲۳)
۴.منطقی ع.۱۳۸۷.کاربرد آنزیم ها در پنیرسازی.مقاله.شرکت صنایع شیر ایران(پگاه)
۵.مفاخری س.۱۳۸۵.(میکروبیولوژی صنعتی)www.organism.blogfa.com.
۶.سید مصطفی رضازاده .کازئین. ۱۳۸۸.www.samfad.blogfa.com
۷.Isam A.A.M٫ I.Morishima٫E. E.Babiker٫N. Mori .۲۰۰۹.Dubiumin ٫ a chymotrypsin- like serine protease from the seeds of Solanum dubium Fresen .۷۰(۴)٫PP:۴۸۳-۴۹۱
۸.Rodrigues durte.A٫ D. Rodrigues durte٫K. Aparecida Moreira٫M.Taciana Holanda Cavalcanti٫J.Luiz de lima- filho٫A.Lucia figueiredo porto.۲۰۰۹.Jacaratia corumbensis o.Kuntze a new vegetable source for milk-clotting enzymes.
۹. shieh C.J٫L. Phan Thi and I-L. shih.۲۰۰۸.Milk- clotting enzymes prouduced by culture of Bacillus subtilis natto.
ارائه دهندگان:
ریحانه صادقی
فاطمه معبودی
سیده آمنه موسوی
ایران مسعود پزشکیان دولت چهاردهم پزشکیان مجلس شورای اسلامی محمدرضا عارف دولت مجلس کابینه دولت چهاردهم اسماعیل هنیه کابینه پزشکیان محمدجواد ظریف
پیاده روی اربعین تهران عراق پلیس تصادف هواشناسی شهرداری تهران سرقت بازنشستگان قتل آموزش و پرورش دستگیری
ایران خودرو خودرو وام قیمت طلا قیمت دلار قیمت خودرو بانک مرکزی برق بازار خودرو بورس بازار سرمایه قیمت سکه
میراث فرهنگی میدان آزادی سینما رهبر انقلاب بیتا فرهی وزارت فرهنگ و ارشاد اسلامی سینمای ایران تلویزیون کتاب تئاتر موسیقی
وزارت علوم تحقیقات و فناوری آزمون
رژیم صهیونیستی غزه روسیه حماس آمریکا فلسطین جنگ غزه اوکراین حزب الله لبنان دونالد ترامپ طوفان الاقصی ترکیه
پرسپولیس فوتبال ذوب آهن لیگ برتر استقلال لیگ برتر ایران المپیک المپیک 2024 پاریس رئال مادرید لیگ برتر فوتبال ایران مهدی تاج باشگاه پرسپولیس
هوش مصنوعی فناوری سامسونگ ایلان ماسک گوگل تلگرام گوشی ستار هاشمی مریخ روزنامه
فشار خون آلزایمر رژیم غذایی مغز دیابت چاقی افسردگی سلامت پوست