جمعه, ۱۰ اسفند, ۱۴۰۳ / 28 February, 2025
اتر چیست
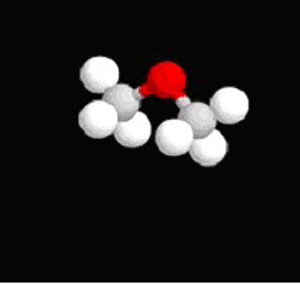
اترها ، ترکیباتی با فرمول عمومی R-O-R ، Ar-O-R یا Ar-O-Ar هستند. (Ar ، فنیل یا یک گروه آروماتیک دیگر است).
● نامگذاری اترها
برای نامیدن اترها ، معمولا دو گروه متصل به اکسیژن را نام میبریم و به دنبال آن ، واژه اتر را میآوریم. اگر دو گروه یکسان باشند، گفته میشود اتر متقارن است ( مانند دی اتیل اتر ، دی ایزوپروپیل اتر ). اگر دو گروه متفاوت باشند، اتر ، نامتقارن است مانند ترسیوبوتیل متیل اتر.
● خواص فیزیکی اترها
از آنجا که زاویه پیوند C-O-C در اتر ، ۱۸۰ درجه است، گشتاورهای دو قطبی دو پویند C-O یکدیگر را خنثی نمیکنند؛ در نتیجه ، اترها مقداری گشتاور دو قطبی برآیند دارند. (مثلا ۱۸۰.۱ برای دی اتیل اتر). این قطبیت کم بر دمای جوش اترها تاثیر چندانی ندارد. دماهایی که در حدود دمای جوش آلکانها با وزن مولکولی مشابهند و از دمای جوش الکلهای ایزومری ، بسیار پایینترند، به عنوان مثال ، دمای جوش n- هپتان ( ْ۹۸دجه سانتیگراد ) ، متیل n- پنتیل اتر ( ۱۰۰درجه سانتیگراد ) و n- هگزیل الکل ( ۱۵۷درجه سانتیگراد ) را با یکدیگر مقایسه کنید. پیوند هیدروژنی که مولکولهای الکل را با قدرت در کنار یکدیگر نگه میدارد، در اترها ممکن نیست؛ چون آنها فقط دارای هیدروژنهایی هستند که به کربن متصلاند.
از سوی دیگر ، انحلالپذیری اترها و الکلها در آب در یک حدود است. به عنوان مثال ، دیاتیل اتر و n-بوتیل الکل ، تقریبا به میزان ۸ گرم در ۱۰۰ گرم آب حل میشوند. ما انحلالپذیری الکلهای سبک در آب را به پیوند هیدروژنی بین مولکولهای آب و الکهای آب نسبت دادیم. انحلالپذیری اترها در آبها را نیز بر همین اساس میتوان تبیین کرد: از طریق الکترونهای به اشتراک گذاشته نشده اکسیژن ، اتر می تواند با هیدروژن آب ، پیوند هیدروژنی تشکیل دهد.
● منابع صنعتی اترها
تعدادی از اترهای متقارن دارنده گروههای آلکیل کوچک در مقیاس بزرگ تولید میشوند و بهعنوان حلال مورد استفاده قرار میگیرند. مهمترین آنها ، دیاتیل اتر است، یعنی همان حلال آشنایی که در استخراجها و در تهیه واکنشگرهای گرینیار مورد استفاده قرار میگیرند. نمونههای دیگری از این نوع اترها ، دیایزوپروپیل اتر و دی-n-بوتیل اتر است.
این اترها در اثر واکنش الکلهای مربوطه با اسید سولفوریک حاصل میشوند.
از آنجا که از هر جفت الکل ، یک مولکول آب حذف میشود، واکنش از نوع آبزدایی است. الکلها میتوانند با نوع دیگری آبزدایی ، واکنش حذفی به آلکن تبدیل شوند. آبگیری از الکلها و بدست آوردن اتر به جای آلکن ، با انتخاب شرایط واکنش کنترل میشود. بهعنوان مثال ، اتیلن با گرم کردن اتیل الکل با اسید سوفلوریک غلیظ تا ۱۸۰ درجه سانتیگراد تهیه میشود.
دیاتیل اتر با گرم کردن مخلوطی از اتیل الکل و اسیدسولفوریک غلیظ تا ۱۴۰ درجه سانتیگراد بدست میآید، در حالیکه الکل دائما به مخلوط اضافه میشود تا فزونی مقدار آن حفظ شود. روش آبزدایی ، عموما به تهیه اترهای متقارن محدود است، چون ، همانگونه که انتظار میرود، ترکیبی از دو الکل ، معمولا میتواند مخلوطی از سه اتر بدهد.
● تهیه اترها از طریق سنتز ویلیامسون
در آزمایشگاه ، سنتز اتر به روش ویلیامسون بدلیل تنوعپذیری آن ، بسیار مهم است و میتوان آن را برای سنتز اترهای متقارن و نامتقارن بکار برد. در سنتز ویلیامسون ، یک آلکیل هالید (یا آلکیل هالید استخلاف شده) را با یک سدیم آلکوکسید ترکیب میکنند. بهعنوان مثال:
R-X + Na-O-R۱ -----> R-O-R۱ + NaX
ایران مسعود پزشکیان دولت چهاردهم پزشکیان مجلس شورای اسلامی محمدرضا عارف دولت مجلس کابینه دولت چهاردهم اسماعیل هنیه کابینه پزشکیان محمدجواد ظریف
پیاده روی اربعین تهران عراق پلیس تصادف هواشناسی شهرداری تهران سرقت بازنشستگان قتل آموزش و پرورش دستگیری
ایران خودرو خودرو وام قیمت طلا قیمت دلار قیمت خودرو بانک مرکزی برق بازار خودرو بورس بازار سرمایه قیمت سکه
میراث فرهنگی میدان آزادی سینما رهبر انقلاب بیتا فرهی وزارت فرهنگ و ارشاد اسلامی سینمای ایران تلویزیون کتاب تئاتر موسیقی
وزارت علوم تحقیقات و فناوری آزمون
رژیم صهیونیستی غزه روسیه حماس آمریکا فلسطین جنگ غزه اوکراین حزب الله لبنان دونالد ترامپ طوفان الاقصی ترکیه
پرسپولیس فوتبال ذوب آهن لیگ برتر استقلال لیگ برتر ایران المپیک المپیک 2024 پاریس رئال مادرید لیگ برتر فوتبال ایران مهدی تاج باشگاه پرسپولیس
هوش مصنوعی فناوری سامسونگ ایلان ماسک گوگل تلگرام گوشی ستار هاشمی مریخ روزنامه
فشار خون آلزایمر رژیم غذایی مغز دیابت چاقی افسردگی سلامت پوست