یکشنبه, ۵ اسفند, ۱۴۰۳ / 23 February, 2025
چه کسی بیشتر عمر می کند
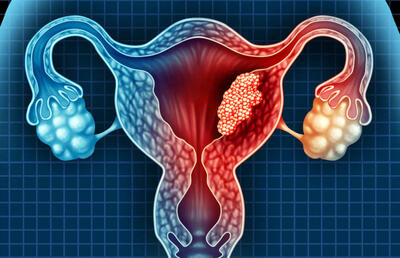
در چند دهه اخیر، به علت تغییر در اپیدمیولوژی و افزایش تعداد عوامل شیمیدرمانی هدفمند، اهمیت تعیین زیرگروه هیستولوژیک کانسر ریه سلول غیرکوچک (NSCLC) افزایش یافته است. روند افزایش طول عمر بیماران مبتلا به NSCLC پیشرفته، کماکان آهسته است. به منظور بهینه کردن درمان برای هر بیمار منفرد، نتایج منتشر شده آزمایشات بالینی به طور مرتب اطلاعاتی درباره عوامل پروگنوستیک و عواملی که میتوانند تاثیر دارو را پیشبینی کنند، در اختیار میگذارند....
در گذشته، اهمیت پروگنوستیک زیرگروه هیستولوژیک در NSCLC پیشرفته با اطمینان نشان داده نشده، البته اغلب برای بیماران NSCLC که در مطالعات بالینی پذیرش میشوند، زیرگروههای هیستولوژیک مشخص میشوند، اما بررسیهایی که درباره همراهی بالقوه بین هیستولوژی و اثربخشی درمان صورت میگیرند، معمولا گزارش نمیشوند.
لیکن، اخیرا نتایج دو مطالعه فاز III کنترل شده اتفاقی روی شیمیدرمانی سیتوتوکسیک، موجب احیای توجه به تأثیر هیستولوژی NSCLC بر اثر بخشی درمان شده است. آنالیز گذشتهنگر یک مطالعه که پمترکسد را به عنوان خط دوم درمان با دوستاکسل در NSCLC مقایسه نمود و همچنین آنالیز آیندهنگر مطالعهای که پمترکسد + سیسپلاتین را به عنوان خط اول درمان در NSCLC با جمسیتابین + سیسپلاتین مقایسه کرد، به لحاظ آماری رابطه قابلتوجهی را بین درمان و هیستولوژی (درمان براساس هیستولوژی) تشخیص دادند. به این صورت که بیماران مبتلا به کارسینومای غیراسکواموس درمان شده با پمترکسد، میزان بقای طولانیتر و بیماران مبتلا به کارسینومای سلول اسکواموس درمان شده با پمترکسد میزان بقای کوتاهتری داشتند. به علاوه، مطالعه سومی نیز که دو دوز پمترکسد را به عنوان درمانهای خط دوم و سوم در NSCLC مقایسه نمود، نشان داد که اثربخشی آن بر حسب هیستولوژی تفاوت دارند.
با توجه به نتایج این مطالعات اتفاقی شده و به دلیل اهمیت روزافزون درمانهای هدفمند بر آن شدیم تا شمول نگاه درمانی این مقاله را افزایش بخشیده و مطالعهای مروری را درباره چگونگی ارتباط هیستولوژی با انتخاب درمان ارایه کنیم. نویسندگان این مطالعه بررسی کردهاند که آیا مطالعات پیشین روی داروهایی به غیر از پمترکسد نیز رابطهای را بین هیستولوژی و پیامدهای بالینی مشاهده کرده بودند یا خیر.
● پمترکسد
پمترکسد یا Alimta یک آنتیفولات نوین است که آنزیمهای دخیل در سنتز پورین و پیریمیدین را مهار میکند. پمترکسد عمدتا از طریق حامل احیا شده فولات وارد سلول میشود و تحت پلیگلوتاماسیون داخل سلولی وسیعی قرار میگیرد. اشکال پلیگلوتاماته برای دورههای طولانی درون سلول نگاه داشته میشوند و میل ترکیبی آنها با آنزیمهای دخیل در سنتز پورین و پیریمیدین بالغ بر ۱۰۰ برابر بیشتر از داروی اصلی یعنی پمترکسد مونوگلوتامات است.
ما (نویسندگان) یازده مطالعه را که همراهی بین هیستولوژی و نتایج بالینی را در NSCLC مرحله آخر نشان داده بودند، بررسی کردیم. در هر یازده مورد، طراحی مطالعه و/یا نوع آنالیزها به ما اجازه نمیداد که به روشنی بین یک ارتباط پروگنوستیک یا ارتباط پیشبینیکننده تمایز قایل شویم. در برخی از موارد، هیستولوژی نقشی هم پروگنوستیک و هم پیشبینی کننده داشته است. هفت مطالعه مقایسهای دیگر نیز به این نتیجه رسیدند که زیرگروه هیستولوژیک میتواند اثربخشی شیمیدرمانیهای سیتوتوکسیک رایج خاصی را پیشبینی نماید و یافته سیزده مطالعه این بود که هیستولوژی در بیماران درمان شده با مهارکنندههای تیروزینکیناز EGFR، پروگنوستیک و/یا پیشبینی کننده بود.
● اثربخشی مهار کنندههای تیروزین کیناز
ثابتترین ارتباط بین هیستولوژی ونتیجه درمان، در مورد مهار کنندههای تیروزین کیناز EGFR دیده شد. نکته جالبتوجه این بود که همراهی بین آدنوکارسینوما و اثربخشی بیشتر در بیماران درمان شده با مهارکنندههای EGFR از ابتدا نتیجه مورد حدس نبود، بلکه در ابتدا این نظریه مطرح شد که نتیجه بهتر باید با کارسینومای سلول اسکواموس همراه باشد، زیرا در این کارسینوما EGFR به میزان بالایی بروز میکند. دادههای جدیدتر پیشنهاد میکنند که اثربخشی مهار کنندههای تیروزین کیناز EGFR میتواند به توانایی آنها در مسدود کردن ارسال سیگنال در مسیر نابهجای EGFR همراه با موتاسیونهای گیرنده فعالکننده مرتبط بوده یا اینکه میتواند مربوط به افزایش تعداد نسخه ژنی EGFR باشد. بهرغم فقدان اطلاع دقیق از مکانیسم عمل مهارکنندههای EGFR، هیستولوژی آدنوکارسینوما میتواند برای تعیین آن دسته از بیمارانی که به احتمال بیشتری از مهارکنندههای تیروزین کیناز EGFR سود میبرند، مورد استفاده قرار گیرد.
یک محدودیت این مرور، همانند هر مرور یا متاآنالیزی، تورش انتشار مطالعه است. این تورش زمانی اتفاق میافتد که نتایج منفی (در این مورد، نتایج منفی هیستولوژی) که اغلب منتشر نمیشوند، نادیده گرفته میشوند. آنالیز اثربخشی بر اساس زیرگروه هیستولوژیک به چند دلیل ممکن است گزارش نشود: دادههای هیستولوژیک جمعآوری نشدهاند، به علت قدرت ناکافی مطالعه آنالیز صورت نگرفته یا به خاطر شواهد تاریخی چنین آنالیزهایی مهم نبودهاند، آنالیز انجام شده، ولی نتایج منفی بودهاند و بنابراین گزارش نشدهاند یا به خاطر اینکه چگونگی تفسیر یافتهها روشن نبوده است.
دلایل متعددی وجود دارد که چرا برخی از مطالعاتی که هیستولوژی را به عنوان یک عامل پروگنوستیک/ پیشبینیکننده مورد بررسی قرار دادند، ارتباطی را مشاهده نکردهاند. واضحترین دلیل این است که آن مطالعه احتمالا به درستی نتیجه گرفته که همراهی هیستولوژی با اثربخشی درمان نه به اندازه کافی پروگنوستیک است و نه پیشبینی کننده. چنین وضعیتی بهویژه میتواند برای مطالعاتی صادق باشد که به دنبال نقش پیشبینیکننده عوامل شیمیدرمانی سیتوتوکسیکی هستند (برای مثال، آنزیمها یا گیرندهها) که تاثیر ساختاری آنها در تمام سلولها یکسان است.
دلیل دیگر برای اینکه هیستولوژی به عنوان عامل پروگنوستیک یا پیشبینی کننده شناخته نشود، این است که طراحی مطالعه، جمعیت مطالعه و/یا آنالیزهای آماری برای این منظور کافی نبودهاند. برای مثال، در متاآنالیزهایی که نتایج مطالعات مختلف شامل درمانهای گوناگون و دموگرافیهای مختلف بیماران ترکیب میشوند، تفاوتهای مابین زیرگروههای مختلف بیماران پوشیده میشوند. آنالیزهایی که بازوهای درمانی را با هم ترکیب میکنند، میتواند به نتایجی متفاوت از نتایج جداگانه بازوهای مطالعه منجر شوند.
در بسیاری از مطالعات ناکافی بودن طراحی مطالعه به معنی کافی نبودن اندازه نمونه است. ناکافی بودن اندازه نمونه همچنین میتواند به ترکیب شدن زیرگروههای هیستولوژیک بینجامد که خود یک اثر مهم را در یک زیرگروه هیستولوژیک نسبتا ناشایع پنهان میکند. حتی درون یک زیرگروه هیستولوژیک با مورفولوژی مشخص مانند آدنوکارسینوما، زیرگروههای متعددی میتوانند وجود داشته باشند که هر یک با پیشآگهی و/یا پاسخدهی متفاوتی به یک داروی خاص همراه باشند. در نتیجه، زمانی که این زیرگروهها با یک دیگر آنالیز میشوند، پیشآگهی یا پاسخدهی بهتر برخی از زیرگروهها میتواند در اثر پیشآگهی یا عدم پاسخدهی گروههای دیگر کمرنگ شود.
● نتایج و توصیهها
با وجود تفاوتهای موجود در طراحی مطالعات و آنالیزهای صورت گرفته، شواهد بیانگر آن هستند که هیستولوژی میتواند برای تعیین اثربخشی درمان پروگنوستیک و پیشبینی کننده باشد.
با توجه به پیدایش درمانهای هدفمند و اصلاح طبقهبندیهای هیستولوژیک، مطالعات بیشتری باید در برگیرنده آنالیز زیرگروههای هیستولوژیک و همراهی آنها با اثربخشی درمان باشند. به ویژه با توجه به افزایش چشمگیر شیوع آدنوکارسینوما، نیاز به چنین آنالیزهایی بیشتر است. در مورد برخی از درمانها، هیستولوژی تومور به علاوه گروه فزایندهای از مارکرهای زیستی، این پتانسیل را دارند که بیمارانی را که از آن درمانها سود میبرند، مشخص کنند و در نتیجه از درمانهای غیرضروری و اثرات جانبی توکسیک در آنها جلوگیری شود. به علاوه، از آنجایی که بهتازگی ارتباطی بین زیرگروه هیستولوژیک و توکسیسیته مشخص شده (به عبارت دیگر، بیماران مبتلا به تومورهای سلول سنگفرشی در خطر عوارض هموراژیک ناشی از درمان با Bevacizumab هستند) مطالعات بیشتری باید آنالیز همراهی بین زیرگروههای هیستولوژیک و توکسیسیتیهای مهم بالینی را نیز در برگیرند.
با بیشتر شدن اتکای ما بر زیرگروه هیستولوژیک برای تعیین درمان مطلوب، اهمیت تشخیص قطعی هیستولوژیک نیز افزایش مییابد.
دکتر محسن پرورش
ایران مسعود پزشکیان دولت چهاردهم پزشکیان مجلس شورای اسلامی محمدرضا عارف دولت مجلس کابینه دولت چهاردهم اسماعیل هنیه کابینه پزشکیان محمدجواد ظریف
پیاده روی اربعین تهران عراق پلیس تصادف هواشناسی شهرداری تهران سرقت بازنشستگان قتل آموزش و پرورش دستگیری
ایران خودرو خودرو وام قیمت طلا قیمت دلار قیمت خودرو بانک مرکزی برق بازار خودرو بورس بازار سرمایه قیمت سکه
میراث فرهنگی میدان آزادی سینما رهبر انقلاب بیتا فرهی وزارت فرهنگ و ارشاد اسلامی سینمای ایران تلویزیون کتاب تئاتر موسیقی
وزارت علوم تحقیقات و فناوری آزمون
رژیم صهیونیستی غزه روسیه حماس آمریکا فلسطین جنگ غزه اوکراین حزب الله لبنان دونالد ترامپ طوفان الاقصی ترکیه
پرسپولیس فوتبال ذوب آهن لیگ برتر استقلال لیگ برتر ایران المپیک المپیک 2024 پاریس رئال مادرید لیگ برتر فوتبال ایران مهدی تاج باشگاه پرسپولیس
هوش مصنوعی فناوری سامسونگ ایلان ماسک گوگل تلگرام گوشی ستار هاشمی مریخ روزنامه
فشار خون آلزایمر رژیم غذایی مغز دیابت چاقی افسردگی سلامت پوست